
科目: 来源: 题型:解答题
| 序号 | 实验步骤和结论 |
| ① | 比较浓度均为0.1mol•L-1的A和E的pH的大小为:7<A<E |
| ② | 1L pH=9的A分别与x L 0.001mol•L-1 B,y L 0.001mol•L-1D充分反应后,当溶液均呈中性时x、y的大小关系为:y<x; |
| ③ | pH=a的C与pH=b的D,且a+b=14,等体积混合发生酸碱中和反应后,溶液呈碱性. |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 产生的无色气体中一定有CO2,可能有SO2 | |
| B. | 溶液中一定存在Br-、CO32,不存在Al3+、SO32- | |
| C. | 溶液中一定存在K+,可能存在Al3+、Cl- | |
| D. | 溶液变橙色时发生反应的离子方程式为Br-+Cl2=Br2+Cl- |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
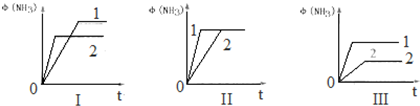
查看答案和解析>>
科目: 来源: 题型:选择题
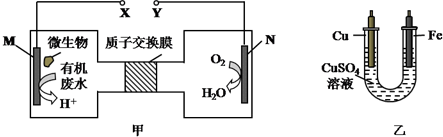
| A. | 乙装置中溶液颜色会变浅 | |
| B. | 铁电极应与Y相连接 | |
| C. | M电极反应式:H2NCONH2+H2O-6e-═CO2↑+N2↑+6H+ | |
| D. | 当N电极消耗0.25mol气体时,则铜电极质量减少16g |
查看答案和解析>>
科目: 来源: 题型:选择题
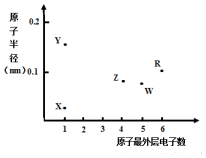 X、Y、Z、W、R为五种短周期元素,其原子半径和最外层电子数之间的关系如图所示.下列说法错误的是( )
X、Y、Z、W、R为五种短周期元素,其原子半径和最外层电子数之间的关系如图所示.下列说法错误的是( )| A. | 简单离子半径:Y<W | |
| B. | 最高价氧化物对应水化物的酸性:Z<W | |
| C. | R为氧元素 | |
| D. | X与Z可以形成正四面体结构的分子 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 完全中和所需NaOH的量 | B. | CH3COOH的电离程度 | ||
| C. | 溶液中H+的物质的浓度 | D. | CH3COOH的物质的量 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 0.1molKClO4 | B. | 0.1molKClO3 | C. | 0.2molKClO2 | D. | 0.1molKClO2 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 质量 | B. | 密度 | C. | 碳原子数 | D. | 原子总数 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com