
科目: 来源: 题型:选择题
| A. | 离子半径大小顺序:r(Z2+)>r(Y2-) | |
| B. | Y分别与Z、W形成的化合物中化学键类型相同 | |
| C. | X的最高价氧化物对应的水化物的酸性比W的强 | |
| D. | 单质的熔点Z>W |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:选择题
 肼(N2H4)暴露在空气中容易爆炸,但利用其作燃料电池是一种理想的电池,具有容量大、能量转化率高、产物无污染灯特点,其工作原理如图所示,下列叙述正确的是( )
肼(N2H4)暴露在空气中容易爆炸,但利用其作燃料电池是一种理想的电池,具有容量大、能量转化率高、产物无污染灯特点,其工作原理如图所示,下列叙述正确的是( )| A. | 电池工作时,正极附近的pH降低 | |
| B. | 当消耗1molO2时,有2molNa+由甲槽向乙槽迁移 | |
| C. | 负极反应为4OH-+N2H4-4e-=N2↑+4H2O | |
| D. | 若去掉离子交换膜电池也能正常工作 |
查看答案和解析>>
科目: 来源: 题型:实验题
 某化学兴趣小组用以下装置探究SO2的某些化学性质.
某化学兴趣小组用以下装置探究SO2的某些化学性质.查看答案和解析>>
科目: 来源: 题型:推断题
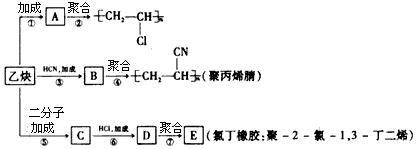
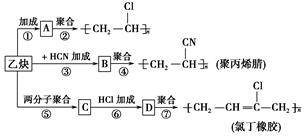
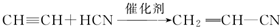 ;加成反应
;加成反应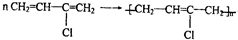 ;加聚反应
;加聚反应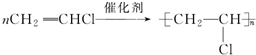 ,写出聚氯乙烯的链节
,写出聚氯乙烯的链节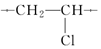 ,单体的结构简式CHCl═CH2;
,单体的结构简式CHCl═CH2;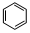 .
.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 0.4mol | B. | 0.5mol | C. | 0.6mol | D. | 0.8mol |
查看答案和解析>>
科目: 来源: 题型:计算题
查看答案和解析>>
科目: 来源: 题型:选择题
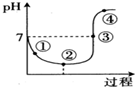
| A. | 点①所示溶液中:c(H+)=c(Cl-)+c(HClO)+c(OH-) | |
| B. | 点②所示溶液中:c(H+)>c(Cl-)>c(ClO-)>c(HClO) | |
| C. | 点③所示溶液中:c(Na+)=2c(ClO-)+c(HClO) | |
| D. | 点④所示溶液中:c(Na+)>c(ClO-)>c(Cl-)>c(HClO) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com