
科目: 来源: 题型:选择题
| A. | 强电解质都是离子化合物,弱电解质都是共价化合物 | |
| B. | 强电解质的水溶液中无溶质分子,弱电解质的水溶液中有溶质分子 | |
| C. | 向FeBr2溶液中加入过量的氯水,加热蒸发得FeCl3晶体 | |
| D. | 向Na2CO3饱和溶液中,通入过量的CO2后,加热蒸干得NaHCO3晶体 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | c(OH-)=c(HCO3-)+c(H2CO3) | B. | 2c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) | ||
| C. | c(Na+)+c(H+)=c(HCO3-)+c(CO32-)+c(OH-) | D. | c(Na+)>c(CO32-)>c(OH-)>c(HCO3-) |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 表示组成分子中的各原子在空间的位置 | |
| B. | 以共价键相连的两原子间总以一条短线相连 | |
| C. | 结构式和球棍模型在表示分子结构上作用相同 | |
| D. | 用一条短线表示一对共用电子对的图式反映共价分子中各原子的连接顺序 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 芳香烃的获取主要来自煤的干馏和对石油分馏产品的催化重整 | |
| B. | 正丁烷转化为异丁烷一定有能量变化 | |
| C. | 石油的催化裂化主要目的是提高轻质液体燃料的产量尤其是汽油的产量 | |
| D. | 石油的常压分馏能得到润滑油、石蜡等 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | pH=7的溶液中:Fe3+、Cl-、Na+、NO3- | |
| B. | 由水电离出的c(H+)=1×10-13 mol•L-1的水溶液中Na+、CO32-、Cl-、K+ | |
| C. | 无色透明的酸性溶液中NH4+、NO3-、Al3+、Cl- | |
| D. | Al3+、HCO3-、I-、Ca2+ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 用排饱和氯化铵溶液的方法收集氨气 | |
| B. | 用重结晶的方法除去BaSO4固体中混有的NaCl | |
| C. | 将碳酸钙置于蒸发皿中高温灼烧可得到氧化钙 | |
| D. | 将硫酸铜溶液蒸发浓缩、冷却结晶、过滤、洗涤、干燥得到胆矾晶体 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
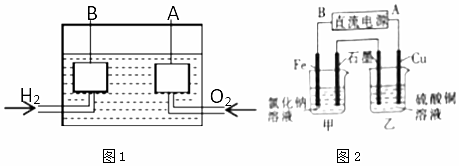
查看答案和解析>>
科目: 来源: 题型:解答题
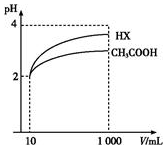 25℃时,三种酸的电离平衡常数如表所示.
25℃时,三种酸的电离平衡常数如表所示.| 化学式 | CH3COOH | HClO | H3PO3 |
| 名称 | 醋酸 | 次氯酸 | 亚磷酸 |
| 电离平衡常数(25℃) | 1.8×10-5 | 3.0×10-8 | K1=8.3×10-3 K2=5.6×10-6 |
查看答案和解析>>
科目: 来源: 题型:选择题
 常温下,向10mLmol•L-1HR溶液中逐滴滴入0.1mol•L-1的氨水,所得溶液pH及导电能力与加入氨水体积的关系如图.下列说法不正确的是( )
常温下,向10mLmol•L-1HR溶液中逐滴滴入0.1mol•L-1的氨水,所得溶液pH及导电能力与加入氨水体积的关系如图.下列说法不正确的是( )| A. | 常温下,电离平衡常数Ka(HR)≈Kb(NH3•H2O) | |
| B. | b点溶液pH=7,此时HR溶液与氨水恰好完全反应 | |
| C. | c点溶液中存在c(NH4+)>c(R-)>c(OH-)>c(H+) | |
| D. | a、b、c三点中,c点NH3•H2O的电离程度最大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com