
科目: 来源: 题型:选择题
| A. | 异丁烷的二氯代物 | |
| B. | 分子式为C6 H14的有机物 | |
| C. | 甲酸正丙酯属于酯的同分异构体 | |
| D. | 分子式为C5H10O2并能与饱和NaHCO3溶液反应放出气体的有机物 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 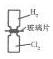 利用如图装置可将H2和Cl2均匀混合 | |
| B. |  利用如图装置可以制备能较长时间存在的Fe(OH)2沉淀 | |
| C. |  利用如图装置加热蒸干NaCl溶液制备NaCl晶体 | |
| D. |  利用如图装置分离苯和甲苯 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 常温下,0.l mol•L-1CH3COOH溶液的pH=3,则CH3COOH的电离平衡常数约为10-5 | |
| B. | 常温下,pH=7的溶液中,K+、NH4+、NO3-、CH3COO-能大量共存 | |
| C. | 将NH3通入热的CuSO4溶液中能使Cu2+还原成Cu | |
| D. | 向Fe(OH)3胶体中逐滴加入盐酸,可观察到先生成红褐色沉淀,后沉淀溶解 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 用铜电极电解Na C l溶液制备Cl2:2C1-+2H2O$\frac{\underline{\;电解\;}}{\;}$ Cl2↑+H2↑+2OH- | |
| B. | 向MgCl2溶液中加入氨水制备Mg(OH)2:Mg2++2OH-═Mg(OH)2↓ | |
| C. | 将Fe S溶于稀硝酸制备Fe(NO3)3:FeS+4 H++NO3═Fe3++NO↑+S↓+2H2O | |
| D. | 用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2 MnO4-+6 H++5 H2O2═2Mn2++5O2↑+8H2O |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 标准状况下,22.4 L Cl2与足量水反应,转移的电子数目等于NA | |
| B. | 17 g-18OH所含的电子数目为9NA | |
| C. | 16 g N2 H4中含有的非极性共价键数目为0.5NA | |
| D. | 常温时,1 L pH=12的 Ba(OH)2溶液中含OH一的数目为2×10-2NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 纤维素在人体内可水解为葡萄糖,故可用作人体的营养物质 | |
| B. | 明矾水解时能生成具有吸附性的胶体粒子,故可用作漂白剂 | |
| C. | Ba2+对人体无毒,故BaSO4在医学上可用作钡餐 | |
| D. | MgO熔点很高,故可用作耐高温材料 |
查看答案和解析>>
科目: 来源: 题型:实验题
 ;悬浊液; (填“溶液”“胶体”或“悬浊液”).
;悬浊液; (填“溶液”“胶体”或“悬浊液”).查看答案和解析>>
科目: 来源: 题型:实验题

| 物质 | 熔点/℃ | 沸点/℃ |
| PCl3 | -112 | 75.5 |
| POCl3 | 2 | 105.3 |
查看答案和解析>>
科目: 来源: 题型:选择题
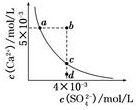
| A. | 在任何溶液中,c(Ca2+)•c(SO42-)均相等 | |
| B. | d点溶液通过蒸发可以变到c点 | |
| C. | b点对应的Ksp大于a点对应的Ksp | |
| D. | b点将有沉淀生成,平衡后溶液中c(SO42-)一定等于3×10-3 mol•L-1 |
查看答案和解析>>
科目: 来源: 题型:选择题
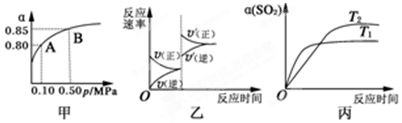
| A. | 由图甲推断,B点SO2的平衡浓度为0.3 mol•L-1 | |
| B. | 由图甲推断,A点对应温度下该反应的平衡常数为800(L•mol-1) | |
| C. | 达平衡后,若增大容器容积,则反应速率变化图象可以用图乙表示 | |
| D. | 压强为0.50 MPa时不同温度下SO2转化率与温度关系如丙图,则T2>T1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com