
科目: 来源: 题型:选择题
| A. | 将Na投入CH3COOH中:2Na+2H+═2Na++H2↑ | |
| B. | 将过量氨水加入到AlCl3溶液中:Al3++4OH-═AlO2-+2H2O | |
| C. | 向氯化银悬浊液中加入溴化钾溶液:Ag++Br-═AgBr↓ | |
| D. | 碳酸氢钙溶液中加入等物质的量的氢氧化钠溶液:Ca2++HCO3-+OH-═CaCO3↓+H2O |
查看答案和解析>>
科目: 来源: 题型:填空题
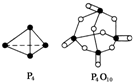 化学反应过程中发生物质变化的同时,常常伴有能量的变化,这种能量的变化常以热能的形式表现出来,叫做反应热.由于反应的情况不同,反应热可以分为许多种,如燃烧热和中和热等.
化学反应过程中发生物质变化的同时,常常伴有能量的变化,这种能量的变化常以热能的形式表现出来,叫做反应热.由于反应的情况不同,反应热可以分为许多种,如燃烧热和中和热等.| 化学键 | P-P | P-O | O═O | P═O |
| 键能kJ/mol | 197 | 360 | 499 | x |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 乙二醇和丙三醇互为同系物 | |
| B. | 醇都可以发生消去反应 | |
| C. | 醇在Cu催化作用下都可以催化氧化 | |
| D. | 饱和一元脂肪醇的化学式可用通式CnH2n+2O表示 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 3个 | B. | 4个 | C. | 5个 | D. | 6个 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 加入铝粉有大量氢气产生的溶液中:Ca2+、K+、NO3-、Cl- | |
| B. | PH=0的无色溶液中:Na+、K+、MnO4-、NO3- | |
| C. | 在0.1mol/L的盐酸中:Fe2+、Na+、ClO-、Ca2+ | |
| D. | 在含有大量Fe3+的溶液中:NH4+、Ca2+、Cl-、K+ |
查看答案和解析>>
科目: 来源: 题型:解答题
 .
.| 碘水的体积(mL) | 标况下氯气的体积(mL) |
| 500 | 56 |
| 500 | 55 |
| 500 | 57 |
查看答案和解析>>
科目: 来源: 题型:选择题
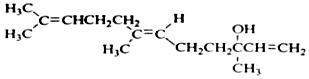 关于橙花醇叙述错误的是( )
关于橙花醇叙述错误的是( )| A. | 可使酸性 KMnO4溶液褪色 | |
| B. | 橙花醇中含有2种官能团 | |
| C. | 在浓硫酸催化下加热脱水,生成的产物不止一种 | |
| D. | 1mol橙花醇在室温下与溴的四氯化碳溶液反应,最多消耗240g溴 |
查看答案和解析>>
科目: 来源: 题型:选择题
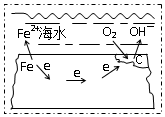
| A. | 电子从碳转移给铁 | |
| B. | 在钢铁上连接铅块,可起到防护作用 | |
| C. | 正极反应为:O2+2H2O+4e→4OH- | |
| D. | 该金属腐蚀过程为析氢腐蚀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com