
科目: 来源: 题型:解答题
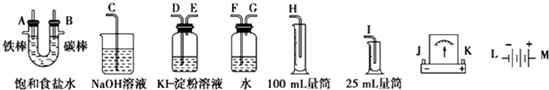
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:填空题
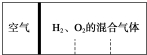 计算后填空:
计算后填空:查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 2H2(g)+O2(g)=2H2O(g);△H12H2(g)+O2(g)=2H2O(l);△H2 | |
| B. | S(g)+O2(g)=SO2(g);△H1S(s)+O2(g)=SO2(g);△H2 | |
| C. | CO(g)+$\frac{1}{2}$O2(g)=CO2(g);△H12CO(g)+O2(g)=2CO2(g);△H2 | |
| D. | H2(g)+Cl2(g)=2HCl(g);△H1$\frac{1}{2}$H2(g)+$\frac{1}{2}$Cl2(g)=HCl(g);△H2 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | $\frac{b}{2a}$mol-1 | B. | $\frac{a}{4b}$mol-1 | C. | $\frac{a}{b}$mol-1 | D. | $\frac{b}{a}$mol-1 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1mol H2含有的分子数目为NA | |
| B. | 24g Mg变为Mg2+时失去的电子数目为NA | |
| C. | 1L 1mol•L-1CaCl2溶液中含有的Cl-离子数目为NA | |
| D. | 常温常压下,11.2LO2中含有的原子数目为NA |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ClO-做还原剂 | B. | Fe(OH)3在反应中被还原 | ||
| C. | 高铁酸钾中铁的化合价为+7 | D. | 制备1molK2FeO4时转移3 mol 电子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com