
科目: 来源: 题型:解答题
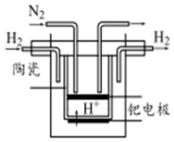 氮的固定对工农业及人类生存具有重大意义.
氮的固定对工农业及人类生存具有重大意义.查看答案和解析>>
科目: 来源: 题型:解答题
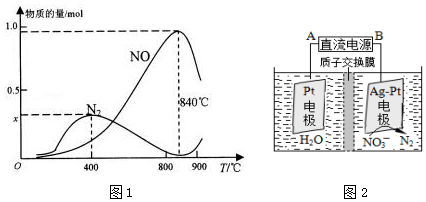
查看答案和解析>>
科目: 来源: 题型:计算题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 检验NH4+时,往试样中加入NaOH溶液,微热,用湿润的蓝色石蕊试纸检验逸出的气体 | |
| B. | 碘易升华,可用加热升华法除去NH4Cl混有的I2 | |
| C. | 铁在硫蒸气中燃烧生成Fe2S3 | |
| D. | 在过氧化钠与水的反应,毎生成0.1mol氧气,转移电子的数目为0.2NA |
查看答案和解析>>
科目: 来源: 题型:解答题
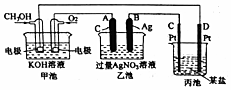
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:实验题

 .
. .
.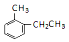 的名称是2-甲基乙苯.
的名称是2-甲基乙苯. +CH3COOH$?_{△}^{浓H_{2}SO_{4}}$
+CH3COOH$?_{△}^{浓H_{2}SO_{4}}$ +H2O.
+H2O. 的一种同分异构体的结构简式
的一种同分异构体的结构简式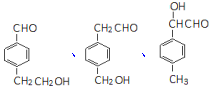 任一种.
任一种.查看答案和解析>>
科目: 来源: 题型:解答题
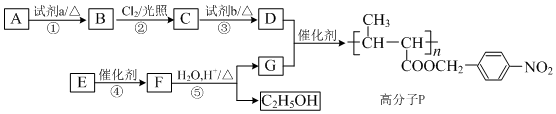
 ,
, +NaOH$→_{△}^{H_{2}O}$
+NaOH$→_{△}^{H_{2}O}$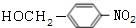 +NaCl.
+NaCl.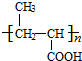 .
.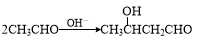
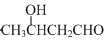 .
.查看答案和解析>>
科目: 来源: 题型:解答题
| 碳 | 氮 | Y | |
| X | 硫 | Z |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com