
科目: 来源: 题型:选择题
| A. | 配位体是Cl-和H2O,配位数是9 | |
| B. | 中心离子是Ti3+,形成配位键时提供电子对 | |
| C. | 配离子是[TiCl(H2O)5]2+,内界和外界中的Cl-的数目比是1:2 | |
| D. | 向含1 mol该配合物的水溶液中加入足量AgNO3溶液,生成AgCl沉淀3 mol |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | π键是由两个p轨道“头碰头”重叠形成的 | |
| B. | σ键就是单键,π键就是双键 | |
| C. | 乙烷分子中的键全为σ键,而乙烯分子中含σ键和π键 | |
| D. | H2分子中含σ键,而Cl2分子中含π键 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 俄国化学家门捷列夫于1869年发表了第一张元素周期表 | |
| B. | 现代化学常利用原子光谱的特征谱线来测定分子的结构 | |
| C. | DNA双螺旋的两个螺旋链是用氢键相结合的 | |
| D. | 区分晶体和非晶体最可靠的科学方法是X-射线衍射实验 |
查看答案和解析>>
科目: 来源: 题型:解答题
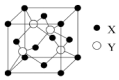 元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为1;元素Y基态原子的3p轨道上有5个电子;元素Z的原子最外层电子数是其内层电子数的3倍;元素W基态原子的核外电子共有16种运动状态.
元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为1;元素Y基态原子的3p轨道上有5个电子;元素Z的原子最外层电子数是其内层电子数的3倍;元素W基态原子的核外电子共有16种运动状态.查看答案和解析>>
科目: 来源: 题型:填空题
| 金刚石 | 晶体硅 | 晶体硼 | |
| 熔点(K) | >3823 | 1683 | 2573 |
| 沸点(K) | 5100 | 2628 | 2823 |
| 硬度(Moh) | 10 | 7.0 | 9.5 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 减小C或D的浓度 | B. | 再加入一定量D | C. | 减小B的浓度 | D. | 增大A或B的浓度 |
查看答案和解析>>
科目: 来源: 题型:实验题
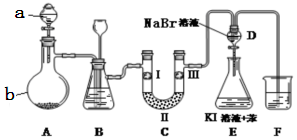
| 实验现象 | 原因 |
| 溶液最初从紫色逐渐变为红色 | 氯气与水反应生成的H+使石蕊变色 |
| 随后溶液逐渐变为无色 | 氯气与水反应生成HClO具有漂白性 |
| 然后溶液从无色逐渐变为浅黄绿色 | 过量氯气溶解于水中 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 标准状况下,11.2 L的甲醇所含的氢原子数等于2NA | |
| B. | 常温下,Na2O2与H2O反应生成1mol O2时,转移电子数是2NA | |
| C. | 标准状况下,2.24 LCl2溶于水中达到饱和,可得到HClO分子的数目是0.1NA | |
| D. | 1L 1 mol/L CuCl2溶液中含有的铜离子数为NA |
查看答案和解析>>
科目: 来源: 题型:解答题
 .
.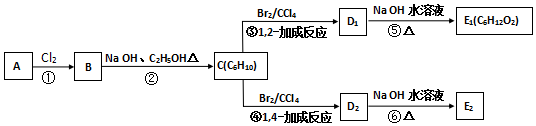
 ,C的化学名称为2,3-二甲基-1,3-丁二烯,E2的结构简式是
,C的化学名称为2,3-二甲基-1,3-丁二烯,E2的结构简式是 ,②的反应类型是消去反应.
,②的反应类型是消去反应. +2NaOH$→_{△}^{H_{2}O}$
+2NaOH$→_{△}^{H_{2}O}$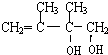 +2NaBr.
+2NaBr.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com