
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:填空题
 +3Br2→
+3Br2→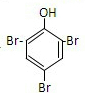 +3HBr
+3HBr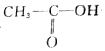 +H-O-CH2CH3$?_{△}^{浓H_{2}SO_{4}}$CH3COOCH2CH3+H2O
+H-O-CH2CH3$?_{△}^{浓H_{2}SO_{4}}$CH3COOCH2CH3+H2O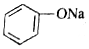 +CO2+H2O→C6H5OH+NaHCO3.
+CO2+H2O→C6H5OH+NaHCO3.查看答案和解析>>
科目: 来源: 题型:选择题
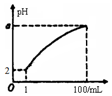 pH=2的弱酸HA溶液1mL,加水稀释到100mL,其pH与溶液体积(V)的关系如图示,下列说法不正确的是( )
pH=2的弱酸HA溶液1mL,加水稀释到100mL,其pH与溶液体积(V)的关系如图示,下列说法不正确的是( )| A. | a的取值范围为2<a<4 | |
| B. | HA溶液加热时,溶液酸性增强 | |
| C. | 与pH=12的NaOH溶液等体积混合后溶液的pH=7 | |
| D. | HA溶液与NaOH溶液恰好完全反应时,c(Na+)>c(A-)>c(OH-)>c(H+) |
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 标况下,燃烧1mol S放出的热量为297.23 kJ | |
| B. | S ( g )+O2 ( g )=SO2 ( g ) 放出的热量大于297.23 kJ | |
| C. | S ( g )+O2 ( g )=SO2 ( g ) 放出的热量小于297.23 kJ | |
| D. | 形成1 mol SO2 的化学键所释放的总能量大于断裂 1 molS ( s )和 1mol O2 ( g )的化学键所吸收的总能量 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | B>A>C | B. | A>B=C | C. | B>A=C | D. | B>C>A |
查看答案和解析>>
科目: 来源: 题型:计算题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 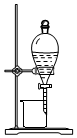 如图所示装置可从碘的CCl4溶液中分离出碘 | |
| B. | 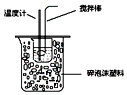 如图所示装置可用于在实验室测定中和反应的反应热 | |
| C. | 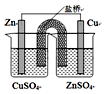 如图所示装置能构成锌铜原电池 | |
| D. | 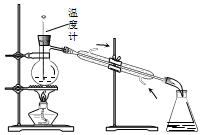 如图所示装置可用于实验室中分馏石油 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | NaOH(aq)+HNO3(aq)=NaNO3 (aq)+H2O(l)△H=+28.7kJ•mol-1 | |
| B. | NaOH+HNO3=NaNO3+H2O△H=-28.7kJ•mol-1 | |
| C. | NaOH(aq)+HNO3 (aq)=NaNO3 (aq)+H2O(l)△H=-57.4 kJ•mol-1 | |
| D. | NaOH(aq)+HNO3 (aq)=NaNO3 (aq)+H2O(l)△H=-57.4 kJ |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 5.6g | B. | 16.8g | C. | 11.2g | D. | 33.6g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com