
科目: 来源: 题型:选择题
| A. | 3.2gO2和O3的混合物中含有的氧原子数目为0.2NA | |
| B. | 1L0.1mol/L的醋酸溶液中含有氢离子数目为0.1NA | |
| C. | 标准状况下,2.24LCCl4含碳原子数目为0.1NA | |
| D. | 将5.85 g NaCl固体溶解在100 mL水中,得到溶液中c(Na+)=1mol/L |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | FeCl3溶液腐蚀铜印刷电路板:2Fe3++Cu═2Fe2++Cu2+ | |
| B. | 硫酸铝溶液中加入过量NaOH溶液:Al3++4OH-═AlO2-+2H2O | |
| C. | 浓NaOH溶液处理少量二氧化硫:SO2+OH-═HSO3- | |
| D. | 盛放NaOH溶液的试剂瓶不能使用玻璃塞:SiO2+2OH-═SiO32-+H2O |
查看答案和解析>>
科目: 来源: 题型:选择题
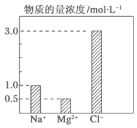 在2L由NaCl、MgCl2、CaCl2组成的混合液中,部分离子浓度大小如图所示,则此溶液中Ca2+离子的物质的量是( )
在2L由NaCl、MgCl2、CaCl2组成的混合液中,部分离子浓度大小如图所示,则此溶液中Ca2+离子的物质的量是( )| A. | 0.5 mol | B. | 1.0 mol | C. | 2.0 mol | D. | 3.0 mol |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1.7 g氨气所含分子数为0.1 NA | |
| B. | 常温常压下,11.2 L氯气所含原子数为NA | |
| C. | 1 mol•L-1的BaCl2溶液中所含Cl-离子数目为2 NA | |
| D. | 71 g氯气与足量铁粉充分反应,转移的电子数为3 NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| X | Y | Z | |
| A | FeCl2 溶液 | FeCl3 | KSCN 溶液 |
| B | H2 | SO2 | NaOH 溶液 |
| C | Fe2(SO4)3溶液 | FeSO4 | Cl2 |
| D | SiO2 | Fe2O3 | NaOH 溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 氢氧化钠溶液中通入足量二氧化硫:SO2+2OH-═SO32-+2H2O | |
| B. | 石灰石与醋酸反应:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| C. | 钠与水反应:Na+2H2O=Na++2OH-+H2↑ | |
| D. | 向少量碳酸氢钠溶液中滴加足量澄清石灰水:Ca2++OH-+HCO3-=CaCO3↓+H2O |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 热稳定性:Na2CO3>NaHCO3 | |
| B. | 相同温度下,0.1mol•L-1盐溶液的pH值:Na2CO3>NaHCO3 | |
| C. | 等质量的碳酸钠和碳酸氢钠分别与足量盐酸反应放出气体的量:Na2CO3<NaHCO3 | |
| D. | 相同温度下,0.1mol•L-1盐溶液分别与0.1mol•L-1HCl反应的剧烈程度:Na2CO3>NaHCO3 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 单晶硅是重要的半导体材料,可用于制造光导纤维 | |
| B. | 钠是一种强还原剂,可以将钛、铌等金属从其熔融的氯化物中置换出来 | |
| C. | 镁燃烧发出耀眼的白光,常用于制造信号弹和焰火 | |
| D. | Fe、Cu分别与Cl2反应,均生成高价氯化物 |
查看答案和解析>>
科目: 来源: 题型:选择题
| 选项 | 分类标准 | 分类结果 |
| A | 根据化学反应中有无单质参加或生成 | 氧化还原反应和非氧化还原反应 |
| B | 根据化学反应中有无离子参加或生成 | 离子反应和非离子反应 |
| C | 根据混合物中分散质粒子直径的大小 | 胶体、溶液和浊液 |
| D | 根据无机化合物的组成和性质特点 | 酸、碱、盐、氧化物等 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:实验题
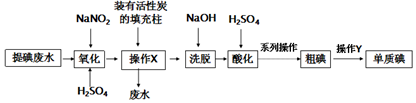
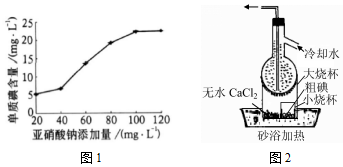 请回答:
请回答:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com