
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
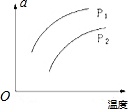 在容积一定的密闭容器中发生可逆反应X(g)+3Y(g)?nZ(g);△H>0,平衡移动关系如图所示.下列说法正确的是( )
在容积一定的密闭容器中发生可逆反应X(g)+3Y(g)?nZ(g);△H>0,平衡移动关系如图所示.下列说法正确的是( )| A. | a可能表示混合气体的密度 | |
| B. | 若n=3,p1>p2,则a可表示Y的质量分数 | |
| C. | 若n=3,p1>p2,则a可表示Y的转化率 | |
| D. | a不可能表示混合气体的平均摩尔质量 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 未达恒重即停止实验 | B. | 加热时有晶体溅出 | ||
| C. | 黏在玻璃棒上固体刮入坩埚 | D. | 固体加热至淡蓝色即停止 |
查看答案和解析>>
科目: 来源: 题型:解答题
 .
.查看答案和解析>>
科目: 来源: 题型:推断题
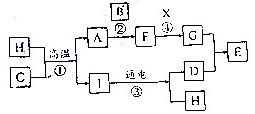 图表示各物质之间的转化关系.已知:A、D、H均为单质,F、H均能和x发生反应,F为浅绿色溶液,E为红褐色固体,E受热生成C.
图表示各物质之间的转化关系.已知:A、D、H均为单质,F、H均能和x发生反应,F为浅绿色溶液,E为红褐色固体,E受热生成C. ;
;查看答案和解析>>
科目: 来源: 题型:选择题
| A. | <0.224L | B. | 0.224L | C. | 0.224L-0.448L | D. | V>0.448L |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com