
科目: 来源: 题型:选择题
| 实验序号 | 起始浓度 | CO2(g)起始速率/mol•L-1•S-1 | |
| c(Br2) | c(HCOOH) | ||
| 1 | 0.01 | 0.02 | 2.0×10-6 |
| 2 | 0.02 | 0.04 | 8.0×10-6 |
| 3 | 0.03 | 0.02 | 6.0×10-6 |
| A. | 1.0×10-6 | B. | 1.0×10-7 | C. | 4.0×10-6 | D. | 5.0×10-7 |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
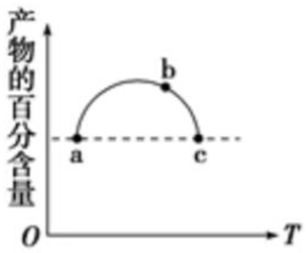 在恒容容器中充入一定量的SO2和Cl2,发生反应SO2(g)+Cl2(g)?SO2Cl2(g),测得体系中产物的百分含量与反应温度的变化如图所示,下列说法正确的是( )
在恒容容器中充入一定量的SO2和Cl2,发生反应SO2(g)+Cl2(g)?SO2Cl2(g),测得体系中产物的百分含量与反应温度的变化如图所示,下列说法正确的是( )| A. | a、b、c三点均为平衡点 | |
| B. | a、c两点的反应速率相同 | |
| C. | b点对应温度的平衡常数大于c点对应温度的平衡常数 | |
| D. | a、c两点体系的压强相同 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 电泳现象可证明胶体带电荷 | |
| B. | 直径在1~100mm之间的粒子称为胶体 | |
| C. | 是否具有丁达尔效应是溶液和胶体的本质区别 | |
| D. | 胶体粒子很小,可以透过滤纸 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 三种气体的质量相等 | |
| B. | 三种气体的物质的量之比为28:2:17 | |
| C. | 三种气体的压强之比为$\frac{1}{28}$:$\frac{1}{2}$:$\frac{1}{17}$ | |
| D. | 三个容器的容积之比为17:2:28 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com