
科目: 来源: 题型:多选题
| A. | Na+、CO32-、SO42-、H+ | B. | K+、AlO2-、H+、Cl- | ||
| C. | Fe2+、K+、H+、SO42- | D. | A13+、H+、NO3-、SO42- |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 常温常压下,92g的NO2和N2O4混合气体所含的原子数为6NA | |
| B. | 标准状况下,将22.4LCl2通入足量的NaOH溶液中,转移的电子数为2NA | |
| C. | 1molFeCl3完全转化为Fe(OH)3胶体后生成胶粒个数为NA | |
| D. | 0.1L0.5mol/LCH3COOH溶液中的H+个数为0.05NA |
查看答案和解析>>
科目: 来源: 题型:实验题
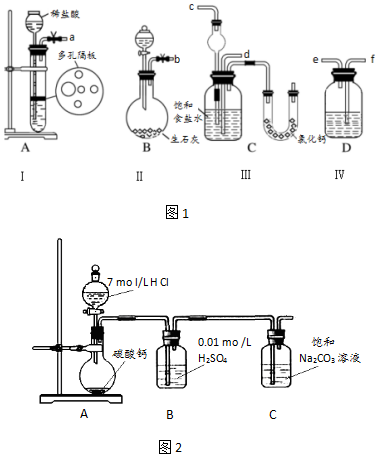
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 3-甲基己烷 | B. | 2-乙基戊烷 | C. | 4-乙基戊烷 | D. | 2,2-二甲基戊烷 |
查看答案和解析>>
科目: 来源: 题型:解答题
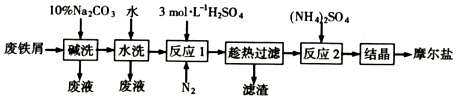
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 在含有大量HCO3-的溶液中:K+、Na+、Al3+、Br- | |
| B. | 使pH试纸变蓝的溶液中:NH4+、Na+、Cl-、ClO- | |
| C. | 含有0.1 mol•L-1Br-离子的溶液中:Cl-、Fe3+、Al3+、Cu2+ | |
| D. | 能使甲基橙变红的溶液中:Na+、K+、SO42-、AlO2- |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 干冰、液态氯化氢都是电解质 | |
| B. | Na2O、Fe2O3、Al2O3既属于碱性氧化物,又属于离子化合物 | |
| C. | 硫酸、烧碱、纯碱、生石灰分别属于酸、碱、盐、氧化物 | |
| D. | 根据是否具有丁达尔效应,将分散系分为溶液、浊液和胶体 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Sn2+ 和Ce3+ | B. | Sn2+ 和Fe2+ | C. | Ce3+和Sn2+ | D. | Fe2+和Ce3+ |
查看答案和解析>>
科目: 来源: 题型:选择题
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向FeBr2溶液中通入少量Cl2 | 溶液由浅绿色变为黄色 | 氧化性:Cl2>Br2 |
| B | 向Na2SO3溶液中滴加盐酸 | 有气体产生 | 非金属性:Cl>S |
| C | 向pH=3的HA和HB溶液中分别加水稀释至100倍 | pH(HA)>pH(HB) | 酸性:HA>HB |
| D | 向重晶石中加入饱和碳酸钠溶液 | 重晶石逐渐溶解 | 溶度积:Ksp(BaCO3)<Ksp(BaSO4) |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com