
科目: 来源: 题型:选择题
| A. | 2molSO2+1molO2 | B. | 2molSO2+1molO2+2molSO3 | ||
| C. | 4molSO2+1molO2 | D. | 3molSO2+0.5molO2+1molSO3 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 晶体硅和金刚石的物理性质相似 | |
| B. | 硅在地壳中含量居第二位,可以以游离态存在于自然界中 | |
| C. | 晶体硅是一种良好的半导体材料,但是它提炼工艺复杂,价格昂贵 | |
| D. | 晶体硅具有金属光泽,故它属于金属材料,可以导电 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 肯定有电子得失 | |
| B. | 肯定是有关氧元素的反应 | |
| C. | 肯定有化合价的变化 | |
| D. | 氧化剂得到电子总数与还原剂失去电子总数相等 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 常温下,500mL 2mol•L-1的Na2CO3溶液中含Na+数目为NA | |
| B. | 常温下,2.7g铝与足量盐酸反应,失去电子数为0.3NA | |
| C. | 1.8gNH4+的离子中含有的质子数为0.1NA | |
| D. | 标准状况下,1 L水所含分子数为$\frac{1}{22.4}$NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1 mol 氧单质一定含有 2 NA 个氧原子 | |
| B. | 含 4 mol Si-O 键的石英晶体中含氧原子数为 4 NA | |
| C. | 6.8 g 液态 KHSO4中含有 0.05 NA 个阳离子 | |
| D. | 1 mol H3O+中含质子数为 10 NA |
查看答案和解析>>
科目: 来源: 题型:解答题
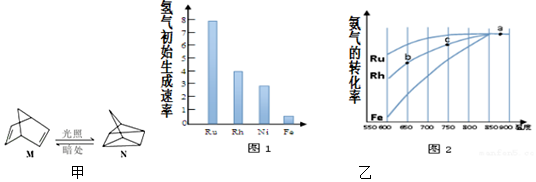
查看答案和解析>>
科目: 来源: 题型:推断题
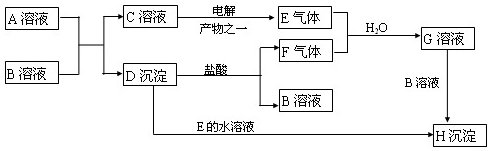
查看答案和解析>>
科目: 来源: 题型:实验题
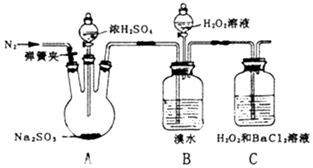 为探究H2O2、SO2、Br2氧化性强弱,某小组同学设计如下实验(夹持及尾气处理装置已略去,气密性已检验).
为探究H2O2、SO2、Br2氧化性强弱,某小组同学设计如下实验(夹持及尾气处理装置已略去,气密性已检验).| 实验操作 | 实验现象 |
| i.打开A中分液漏斗活塞,滴加浓硫酸 | A中有气泡产生,B中红棕色溴水褪色,C中有白色沉淀 |
| ii.取C中沉淀加入盐酸 | C中白色沉淀不溶解 |
| iii.打开B中分液漏斗活塞,逐滴滴加H2O2 | 开始时颜色无明显变化,继续滴加H2O2溶液,一段时间后,混合液逐渐变成红棕色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com