
科目: 来源: 题型:解答题
| 物质 | 颜色 | 水中溶解性 |
| Fe2S3 | 黑色 | 难溶于水 |
| FeS | 黑褐色 | 难溶于水 |
| 实验步骤 | 操作 | 现象 | 备注 |
| 1 | 向2mL 0.1mol/L氯化铁溶液中逐滴滴入3滴0.1mol/L 硫化钠溶液 | 产生黑色沉淀,立即变为黄色沉淀,未见其它明显现象 | 自始至终都未见红褐色沉淀 |
| 2 | 继续滴加3滴0.1mol/L 硫化钠溶液 | 同上 | |
| 3 | 继续滴加0.1mol/L 硫化钠溶液至过量 | 产生黑色沉淀,振荡后静置,未发现明显变化 |
| 实验步骤 | 操作 | 现象 |
| 4 | 向2mL 0.1mol/L硫化钠溶液中逐滴滴入3滴0.1mol/L 氯化铁溶液 | 产生黑色沉淀,未见其它明显现象 |
| 5 | 继续滴加3滴0.1mol/L 氯化铁溶液 | 同上 |
| 6 | 继续滴加0.1mol/L 氯化铁溶液至过量 | 同上 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 氯气是一种重要的化工原料,广泛应用于自来水的消毒和农药的生产等方面 | |
| B. | 钠和钾的合金在常温下是液体,可用于快中子反应堆作热交换剂 | |
| C. | 用二氧化硅制造的光导纤维具有很强的导电能力,可用于制作光缆 | |
| D. | 化肥的生产、金属矿石的处理、金属材料的表面清洗等都可能用到硫酸 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 0.1 | B. | 0.05 | C. | K${\;}_{a1}^{θ}$(H2S) | D. | K${\;}_{{a}_{2}}^{θ}$(H2S) |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 高纯度的单晶硅用于制造光导纤维和登月车的光电池 | |
| B. | 石油裂解的主要目的是为了获得短链不饱和烃 | |
| C. | 按照分散质和分散剂所处的状态,可分为9种分散系 | |
| D. | “地沟油”禁止食用,但可以用来制肥皂或生物柴油 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 汽车的排气管上装有“催化转化器”,使有毒的CO和NO反应生成N2和CO2 | |
| B. | 氢氟酸保存在细口玻璃瓶中 | |
| C. | 高纯度的硅单质广泛用于制作光导纤维 | |
| D. | 大量燃烧化石燃料排放的废气中含CO2、SO2,从而使雨水的pH=5.6形成酸雨 |
查看答案和解析>>
科目: 来源: 题型:解答题
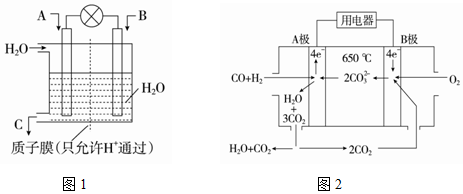
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com