
科目: 来源: 题型:解答题
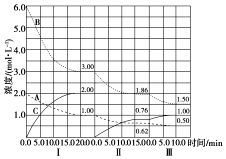 已知某放热热反应在1L的密闭容器中进行反应.保持容器体积不变,改变其他反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各气体物质浓度随时间变化的曲线如图所示:
已知某放热热反应在1L的密闭容器中进行反应.保持容器体积不变,改变其他反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各气体物质浓度随时间变化的曲线如图所示:查看答案和解析>>
科目: 来源: 题型:解答题
 丙烯腈(CH2═CHCN)是一种重要的化工原料,工业上可用“丙烯氨氧化法”生产.主要副产物有丙烯醛(CH2═CHCHO)和乙腈(CH3CN)等.回答下列问题:
丙烯腈(CH2═CHCN)是一种重要的化工原料,工业上可用“丙烯氨氧化法”生产.主要副产物有丙烯醛(CH2═CHCHO)和乙腈(CH3CN)等.回答下列问题:查看答案和解析>>
科目: 来源: 题型:实验题
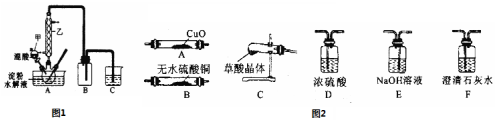
查看答案和解析>>
科目: 来源: 题型:选择题
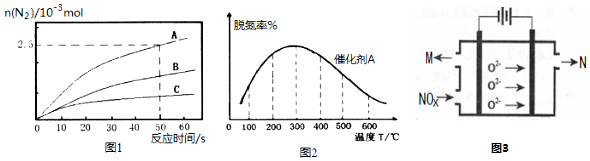
 一定条件下存在反应C(s)+H2O(g)?CO(g)+H2(g)△H>0.向甲、丙两个恒容容器中加入一定量C和H2O(g),向乙恒容容器中加入一定量CO和H2,各容器中温度、反应物的起始量如表,甲、丙反应过程中CO的物质的量浓度随时间变化如图.
一定条件下存在反应C(s)+H2O(g)?CO(g)+H2(g)△H>0.向甲、丙两个恒容容器中加入一定量C和H2O(g),向乙恒容容器中加入一定量CO和H2,各容器中温度、反应物的起始量如表,甲、丙反应过程中CO的物质的量浓度随时间变化如图.| 容器 | 甲 | 乙 | 丙 |
| 容积 | 0.5L | 0.5L | V |
| 温度 | T1℃ | T2℃ | T1℃ |
| 起始量 | 2mol C、 1mol H2O(g) | 1mol CO、 1mol H2 | 4mol C、 2mol H2O(g) |
| A. | 丙容器的容积V<0.5L | |
| B. | 甲容器中,反应在前15 min内的平均反应速率v(H2)=0.15 mol•L-1•min-1 | |
| C. | 当温度为T1℃时,反应的平衡常数K=2.25 | |
| D. | 乙容器中,若平衡时n(H2O)=0.3 mol,则T1<T2 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 苹果放在空气中久置变黄和纸张久置变黄原理相似 | |
| B. | 钢铁制品和铜制品既能发生吸氧腐蚀又能发生析氢腐蚀 | |
| C. | 高温和日常用的消毒剂均可使禽流感病毒变性 | |
| D. | 误食重金属盐引起人体中毒,可饮用大量的食盐水解毒 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | SO2具有氧化性,可用于漂白纸浆 | |
| B. | NaHCO3能与碱反应,可用作焙制糕点的膨松剂 | |
| C. | 浓硫酸具有脱水性,可用于干燥氢气 | |
| D. | MgO、Al2O3熔点高,可用于制作耐火材料 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com