
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ②③ | B. | ①③④ | C. | ②④ | D. | ②③④ |
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 标准状况下,1.12LCCl4含有C-Cl键数目为0.2NA | |
| B. | 标准状况下,2.24L氯气中含有的Cl数目一定为0.2NA | |
| C. | 常温常压下,4.4gCO2与N2O混合气体中含有的原子总数为0.3NA | |
| D. | 56 g的Fe与足量的稀盐酸完全反应转移电子数为3NA |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 苯酚在正极,发生氧化反应 | |
| B. | O2在负极,发生还原反应 | |
| C. | 反应结束后,电解液的酸度可能略有增加 | |
| D. | 正极的电极反应是C6H6O+11H2O-28e-═6CO2+28H+ |
查看答案和解析>>
科目: 来源: 题型:解答题
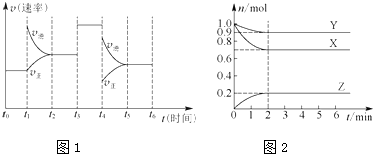
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 硫酸铝溶液与过量Ba(OH)2溶液反应2Al3++3SO42-+3 Ba2++8OH-═3BaSO4↓+2A1O2-+4H2O | |
| B. | 碳酸钠溶液中滴加盐酸至恰好要出现气泡时停止:CO32-+2H+═CO2↑+H2O | |
| C. | 酸性高锰酸钾溶液与H2O2溶液混合:2MnO4-+3H2O2+6H+═2Mn2++6H2O+02↑ | |
| D. | 氯气通入亚硫酸钠溶液中:2Cl2+SO32-+H2O═2Cl-+SO2↑+2HClO |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 甲烷的标准燃烧热为890.3kJ•mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3kJ•mol-1 | |
| B. | CO(g)的燃烧热是283.0kJ/mol,则2CO2(g)═2CO(g)+O2(g)的反应热△H=+2×283.0kJ/mol | |
| C. | HCl和NaOH反应的中和热△H=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ/mol | |
| D. | 500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)═2NH3(g)△H=-38.6 kJ/mol |
查看答案和解析>>
科目: 来源: 题型:解答题
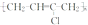 ).
).
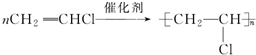 ;
; ;
;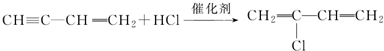 ;
;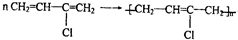 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com