
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:解答题
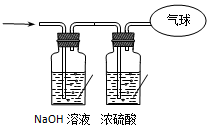 现有16.4克O2和CO2的混合气体,在标准状况下其体积为8.96L.请回答下列问题:
现有16.4克O2和CO2的混合气体,在标准状况下其体积为8.96L.请回答下列问题:查看答案和解析>>
科目: 来源: 题型:解答题
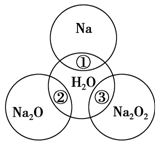 如图所示,两圆圈相交的部分表示圆圈内的物质相互发生的反应.已知钠及其氧化物的物质的量均为0.1mol,水的质量为100g,忽略溶液中溶剂的变化.完成下列题目.
如图所示,两圆圈相交的部分表示圆圈内的物质相互发生的反应.已知钠及其氧化物的物质的量均为0.1mol,水的质量为100g,忽略溶液中溶剂的变化.完成下列题目.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 同温、同压、同体积的12C18O和14N2具有的电子数相等 | |
| B. | 同温、同压、同体积的CO和NO含有的质子数相等 | |
| C. | 同温、同压、同体积的12C18O和14N2密度不相等 | |
| D. | 同温、同压、同体积的一氧化氮(14N18O)和一氧化碳(13C18O)气体含相同的分子数和原子数 |
查看答案和解析>>
科目: 来源: 题型:填空题
 .
.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | SO2具有氧化性,可用于漂白纸浆 | |
| B. | NaHCO3能与碱反应,可用作焙制糕点的膨松剂 | |
| C. | Fe2(SO4)3易溶于水,可用作净水剂 | |
| D. | 液氨汽化时吸收大量的热,可用作制冷剂 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 0.15mol/L | B. | 0.10mol/L | C. | 0.25mol/L | D. | 0.40mol/L |
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 标准状况下,22.4LH2O含有的分子数为NA | |
| B. | 在常温和常压下,22gCO2含有的分子数为0.5NA | |
| C. | 物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl-个数为NA | |
| D. | 在同温、同压下,相同体积的任何气体,所含分子数相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com