
科目: 来源: 题型:解答题
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
查看答案和解析>>
科目: 来源: 题型:选择题
| 酸 | 电离常数K |
| HX | 9×10-7 |
| HY | 9×10-6 |
| HZ | 1×10-2 |
| A. | 三种酸的强弱关系:HX>HY>HZ | |
| B. | 反应HZ+Y -=HY+Z -能够发生 | |
| C. | 相同温度下,0.1mol/L的NaX、NaY、NaZ溶液,NaZ溶液pH最大 | |
| D. | 相同温度下,1mol/L HX溶液的电离常数大于0.1mol/L HX |
查看答案和解析>>
科目: 来源: 题型:实验题
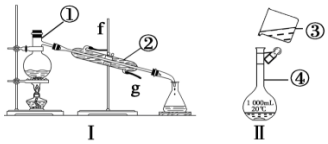
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | NaAlO2溶液中通入过量的CO2:2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32- | |
| B. | FeCl2溶液中加入氯水:Cl2+Fe2+═Fe3++2Cl- | |
| C. | 碳酸氢钠与稀硫酸反应:CO32-+2H+═CO2↑+H2O | |
| D. | NaOH溶液与小苏打溶液反应 HCO3-+OH-═CO32-+H2O |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1molNa2O2与足量二氧化碳反应转移的电子数为2 NA | |
| B. | 标准状况下22.4L CCl4所含的原子数为5NA | |
| C. | 56g Fe与任何物质完全反应时转移的电子数一定为2NA | |
| D. | 1mol镁与足量氧气或氮气反应均失去2NA的电子 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 用胶状氢氧化铝凝聚水中的悬浮物进行净水 | |
| B. | 用红棕色氧化铁制造红色油漆 | |
| C. | 氢氧化铝作为医用的胃酸中和剂 | |
| D. | 用氧化铝制造耐火坩埚和耐火管 |
查看答案和解析>>
科目: 来源: 题型:解答题
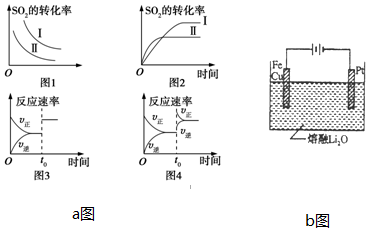
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 明矾水解形成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化 | |
| B. | 在海轮外壳上镶入锌块,可减缓船体的腐蚀速率 | |
| C. | 金属的电化学腐蚀比化学腐蚀更普遍 | |
| D. | 电解MgCl2饱和溶液,可制得金属镁 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com