
科目: 来源: 题型:多选题
| A. | 电解MgCl2饱和溶液,可制得Cl2,但得不到镁 | |
| B. | 镁与稀盐酸反应剧烈,加入碳酸钠晶体可以减慢反应速率 | |
| C. | 电解饱和食盐水制氯气时用铁作阳极 | |
| D. | 电解法精炼粗铜,用纯铜作阴极 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①④ | B. | ②③ | C. | ①②③ | D. | ①③④ |
查看答案和解析>>
科目: 来源: 题型:解答题
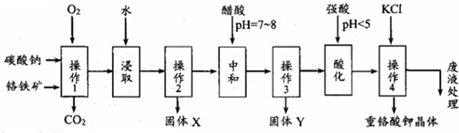
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1 mol HCl气体所含H+数目为NA | |
| B. | 1 mol CO2气体含有的C═O键数为NA | |
| C. | 4.6 g分子式为C2H6O的有机物,所含C-H键数目一定为0.5NA | |
| D. | 1 mol Na2O2所含的阴阳离子总数为3NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| 元素符号 | K | L | M | Q | R | T | N |
| 原子半径/nm | 0.186 | 0.160 | 0.143 | 0.102 | 0.089 | 0.074 | 0.152 |
| 主要化合价 | +1 | +2 | +3 | +6,-2 | +2 | -2 | +1 |
| A. | K、L、M三种元素的单质的还原性逐渐增强 | |
| B. | 在RCl2分子中,各原子最外层均满足8电子的稳定结构 | |
| C. | Q元素的最高价氧化物为电解质,其水溶液能够导电 | |
| D. | K在T单质中燃烧所得的化合物中有共价键 |
查看答案和解析>>
科目: 来源: 题型:填空题

| 溶液 | 加入的物质 | 字母代号 |
| ①饱和石灰水 | 通过量CO2 | B |
| ②AlCl3溶液 | 通过量NH3 | C |
| ③MgCl2、AlCl3混合溶液 | 逐滴加NaOH溶液至过量 | A |
| ④AlCl3溶液 | 逐滴加NaOH溶液至过量 | E |
| ⑤含少量HCl的AlCl3溶液 | 逐滴加NaOH溶液至过量 | F |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 根据物质能否导电将物质分为电解质和非电解质 | |
| B. | 根据反应中的热效应将化学反应分为放热反应和吸热反应 | |
| C. | 根据溶液导电性强弱将电解质分为强电解质和弱非电解质 | |
| D. | 根据元素的化合价的高低将化学反应分为氧化还原反应和非氧化还原反应 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | H2SO4→H2++SO42- | B. | NH3•H2O?NH4++OH- | ||
| C. | Ca(OH)2?Ca2++2OH- | D. | NaHCO3→Na++H++CO32- |
查看答案和解析>>
科目: 来源: 题型:填空题
| A组物质 | 熔点/K | B组物质 | 熔点/K |
| NaCl | 1 074 | Na | 317 |
| KCl | 1 049 | Mg | 923 |
| CsCl | 918 | Al | 933 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com