
科目: 来源: 题型:选择题
| A. | 2Na2O2+2CO2═2Na2CO3+O2,所以2Na2O2+2SO2═2Na2SO3+O2 | |
| B. | 电解熔融NaCl可以得到单质钠,所以电解熔融AlCl3也能得到单质铝 | |
| C. | CH4的空间构型是正四面体,所以CH3Cl的空间构型也是正四面体 | |
| D. | H2S的沸点比H2O低.所以PH3的沸点也比NH3低 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | H2O、H2S、H2Te分子间作用力依次增大 | |
| B. | 金刚石是碳原子间以共价键相结合的原子晶体,加热熔化时需破坏共价键 | |
| C. | 氢氧化钙和氯化铵固体加热制氨气过程中,均有离子键和共价键的断裂和生成 | |
| D. | SiO2和CO2中每个原子的最外层都具有8电子稳定结构 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 分子间作用力越大,分子越稳定 | |
| B. | 气态氢化物共价键越强,热稳定性越高 | |
| C. | 冰融化时水分子中共价键发生断裂 | |
| D. | 氢键是化学键的一种类型 |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:计算题
查看答案和解析>>
科目: 来源: 题型:选择题
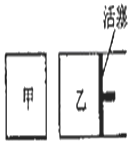 在容积相同的甲、乙两个容器中(如图所示),分别充入2molSO2和2molO2,使它们在相同温度下发生反应2SO2(g)+O2(g)?2S03(g)并达到平衡.在反应过程中,若甲容器的容积不变,乙容器的压强不变,甲中S02的转化率为b%,乙容器中SO2的转化率为a%,则a与b的关系为( )
在容积相同的甲、乙两个容器中(如图所示),分别充入2molSO2和2molO2,使它们在相同温度下发生反应2SO2(g)+O2(g)?2S03(g)并达到平衡.在反应过程中,若甲容器的容积不变,乙容器的压强不变,甲中S02的转化率为b%,乙容器中SO2的转化率为a%,则a与b的关系为( )| A. | 无法确定 | B. | a<b | C. | a=b | D. | a>b |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 向该容器中加入少量A,反应速率增大 | |
| B. | 向该容器中充入氩气,反应速率增大 | |
| C. | 将粉末状A代替块状A能加快反应 | |
| D. | 该反应为放热反应,无需加热即可发生 |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:解答题
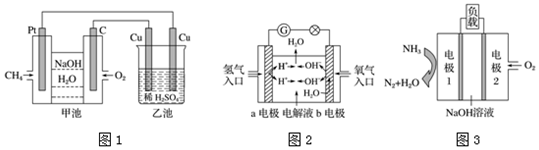
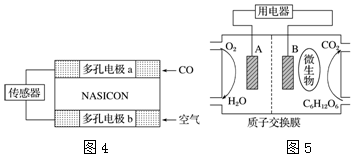
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com