
科目: 来源: 题型:选择题
| A. | ④②⑤③① | B. | ⑤②④①③ | C. | ②⑤④③① | D. | ④①②⑤③ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 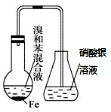 验证苯和液溴在催化剂作用下发生取代反应 | |
| B. | 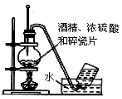 实验室制备并收集乙烯 | |
| C. | 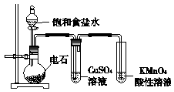 制备乙炔并检验其性质 | |
| D. | 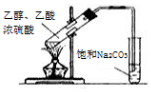 乙醇与乙酸反应制备乙酸乙酯 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
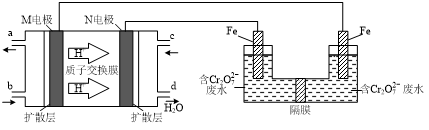
查看答案和解析>>
科目: 来源: 题型:填空题
 .
.查看答案和解析>>
科目: 来源: 题型:多选题
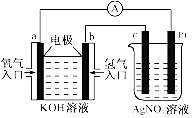 由化学能转变的热能或电能仍然是人类使用的主要能源.根据如图所示的装置,判断下列说法不正确的是( )
由化学能转变的热能或电能仍然是人类使用的主要能源.根据如图所示的装置,判断下列说法不正确的是( )| A. | 该装置中Pt极为阳极 | |
| B. | 当c极的质量变化了2.16g时,a极上消耗的O2在标准状况下的体积为1.12L | |
| C. | 该装置中b极的电极反应式是:H2+2OH--2e-=2H2O | |
| D. | 该装置中a极为正极,发生氧化反应 |
查看答案和解析>>
科目: 来源: 题型:实验题

查看答案和解析>>
科目: 来源: 题型:选择题
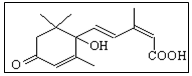 国庆期间对大量盆栽鲜花施用了S-诱抗素制剂,以保证鲜花盛开.S-诱抗素的分子结构如图,下列关于该物质的说法正确的是( )
国庆期间对大量盆栽鲜花施用了S-诱抗素制剂,以保证鲜花盛开.S-诱抗素的分子结构如图,下列关于该物质的说法正确的是( )| A. | 其分子式为C15H18O4 | |
| B. | 分子中存在4种含氧官能团 | |
| C. | 既能发生加聚反应,又能发生缩聚反应 | |
| D. | 1mol该有机物最多可与4molBr2发生加成反应 |
查看答案和解析>>
科目: 来源: 题型:解答题
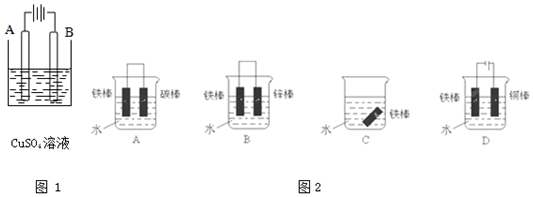
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 食物溶于水后的溶液中pH<7,则为成酸性食物 | |
| B. | 由碳、氮、硫、磷等元素组成的蛋白质多是酸性食物;蔬菜、水果多是碱性食物 | |
| C. | 大米是碱性食物 | |
| D. | 柠檬是酸性食物 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Zn|H2SO4(稀)|C | B. | Cu|AgNO3(aq)|Ag | C. | Zn|CCl4|Cu | D. | Fe|H2SO4(稀)|Cu |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com