
科目: 来源: 题型:选择题
| A. | 每生成0.5 mol N2,反应中转移6 mol电子 | |
| B. | 硝酸钾、硫磺在黑火药爆炸的反应中是氧化剂 | |
| C. | KNO3有强氧化性,乘坐汽车、火车、飞机时不能随身携带 | |
| D. | 上述反应的生成物都是无毒的,所以燃放爆竹时不会污染环境 |
查看答案和解析>>
科目: 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 结论 |
| A | 将过量的CO2通入CaCl2溶液中 | 无白色沉淀出现 | 生成Ca(HCO3)2可溶于水 |
| B | 过量的Fe粉加入HNO3溶液中,充分反应后,滴入KSCN溶液 | 有气泡产生,溶液变红 | 有氢气生产,稀将Fe氧化为Fe3+ |
| C | AgI沉淀中滴入稀KCl溶液 | 有白色沉淀出现 | AgCl比AgI更难溶 |
| D | 将SO2通入Ba(NO3)2中 | 有白色沉淀产生 | 有BaSO4沉淀生产 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 华为自主研发的“麒麟”芯片与光导纤维是同种材料 | |
| B. | 研发煤炭的洁净、高效利用技术,保护生态环境 | |
| C. | 聚氯乙烯可作为包装材料,不会造成环境污染 | |
| D. | “辽宁舰”上用于舰载机降落拦阻索的特种钢缆,属于新型无机非金属材料 |
查看答案和解析>>
科目: 来源: 题型:解答题
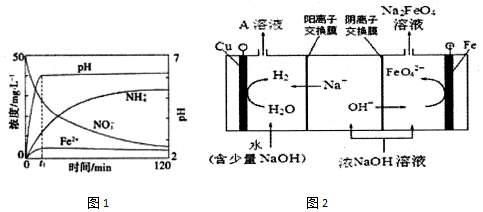
查看答案和解析>>
科目: 来源: 题型:实验题
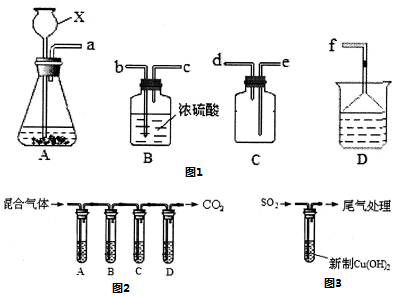
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 将氯化镁溶液加热蒸干:MgCl2+6H2O$\frac{\underline{\;\;△\;\;}}{\;}$ MgCl2•6H2O | |
| B. | 碘水中通适量SO2:I2+SO2+H2O═4H++2I-+SO42- | |
| C. | 氯化铝溶液加入足量氨水:A13++4NH3•H2O=A1O2-+4NH4++2H2O | |
| D. | 氯化铁溶液滴加少量氢硫酸:2Fe3++H2S=2Fe2++S↓+2H+ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=10-8的溶液:K+、Mg2+、C1-、NO3- | |
| B. | 无色透明溶液:Na+、Fe2+、Cl-,SCN- | |
| C. | 中性溶液:K+、A13+、SO42-、S2- | |
| D. | pH=l的溶液:Na+、Fe3+、NO3-、Cl- |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 向碘水中加入有机溶剂提取碘,只能从分液漏斗下口分离出含碘的有机层 | |
| B. | 加入稀盐酸产生无色气体,通入品红溶液不褪色,原溶液中一定含CO32-或HCO3- | |
| C. | 在容量瓶定容时,仰视刻度线滴加蒸馏水,则配制溶液的物质的量浓度偏小 | |
| D. | 进行酸碱中和滴定时,眼睛要始终注视滴定管液面高度的变化 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 铁质罐头盒内层镀上一层耐腐蚀的锡,用于防止铁被腐蚀 | |
| B. | 将氯气通入紫色石蕊试液中先变红后褪色,因氯气具有漂白性 | |
| C. | 从海水中提取物质都必须通过化学反应才能实现 | |
| D. | 相同条件下,CuS在CuSO4溶液中的Ksp比在纯水中更小 |
查看答案和解析>>
科目: 来源: 题型:选择题
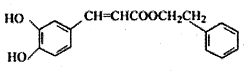
| A. | CPMA的分子式为C17H18O4 | |
| B. | 1 mol CPMA中含有7 mol双键 | |
| C. | 1 mol CPMA最多可与2molNaOH反应 | |
| D. | CPMA能使酸性高锰酸钾溶液、溴水褪色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com