
科目: 来源: 题型:实验题
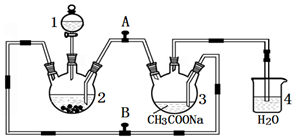 二价铬不稳定,极易被氧气氧化.醋酸亚铬水合物{[Cr(CH3COO)2]2•2H2O,相对分子质量为376}是一种深红色晶体,不溶于冷水和醚,易溶于盐酸,是常用的氧气吸收剂.实验室中以锌粒、CrCl3溶液、醋酸钠溶液和盐酸为主要原料制备醋酸亚铬水合物,其装置如图所示:
二价铬不稳定,极易被氧气氧化.醋酸亚铬水合物{[Cr(CH3COO)2]2•2H2O,相对分子质量为376}是一种深红色晶体,不溶于冷水和醚,易溶于盐酸,是常用的氧气吸收剂.实验室中以锌粒、CrCl3溶液、醋酸钠溶液和盐酸为主要原料制备醋酸亚铬水合物,其装置如图所示:查看答案和解析>>
科目: 来源: 题型:实验题
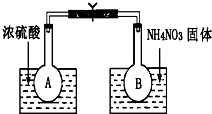 已知:2NO2(g)?N2O4(g)△H=-52.7kJ/mol,某课外活动小组为了探究温度和压强对化学平衡的影响,做了如下两组实验:
已知:2NO2(g)?N2O4(g)△H=-52.7kJ/mol,某课外活动小组为了探究温度和压强对化学平衡的影响,做了如下两组实验:查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 过滤时,漏斗的下端管口紧靠烧杯内壁 | |
| B. | 为了加快过滤速度,可用玻璃棒搅动过滤器中的液体 | |
| C. | 当蒸发皿中的固体完全蒸干后,再停止加热 | |
| D. | 实验完毕后,用手直接取走蒸发皿 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 用氢氧化钠溶液鉴别MgCl2溶液、AlCl3溶液 | |
| B. | 利用丁达尔效应鉴别Fe(OH)3胶体与FeCl3溶液 | |
| C. | 用干燥的红色石蕊试纸鉴别NH3和HCl气体 | |
| D. | 用氯化钙溶液鉴别Na2CO3溶液和NaHCO3两种溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com