
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
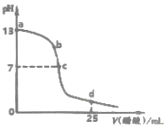 如图为常温下0.2000mol•L-1 CH3COOH溶液逐滴加入到25mL0.1000mol•L-1 NaOH溶液中pH的变化曲线,下列说法不正确的是( )
如图为常温下0.2000mol•L-1 CH3COOH溶液逐滴加入到25mL0.1000mol•L-1 NaOH溶液中pH的变化曲线,下列说法不正确的是( )| A. | a~c区间内(不包含a、c两点)可能存在:c(Na+)>c(OH-)>c(CH3COO-)>c(H+) | |
| B. | c点时溶液中:c(Na+)=c(CH3COO-) | |
| C. | d点时溶液中:c(Na+)+c(H+)+c(CH3COOH)-c(OH-)=0.2000mol•L-1 | |
| D. | 反应过程中溶液中阴、阳离子总数:b点小于c点 |
查看答案和解析>>
科目: 来源: 题型:选择题
| 实 验 事 实 | 结 论 | |
| ① | 在相同温度下,向1mL 0.2mol/L NaOH溶液中滴入2滴0.1mol/L MgCl2溶液,产生白色沉淀后,再滴加2滴0.1mol/LFeCl3溶液,又生成红褐色沉淀 | 溶解度:Mg(OH)2>Fe(OH)3 |
| ② | 将CO2通入到Na2SiO3溶液中产生白色浑浊 | 酸性:H2CO3>H2SiO3 |
| ③ | 在测定溶液中氯离子含量的时候,使用黄色的铬酸钾(K2CrO4)溶液充当指示剂 | 溶度积常数:铬酸银>氯化银 |
| ④ | 已知乙醇和乙酸都能与金属钠反应放出氢气 | 乙醇和乙酸都是电解质 |
| ⑤ | 测定等物质的量浓度的Na2SO4与Na2CO3溶液的pH,后者较大 | 非金属性:S>C |
| A. | ③④⑤ | B. | ②⑤ | C. | ①②③ | D. | 全部 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 少量的铁在氯气中燃烧生成FeCl3,过量的铁在氯气中燃烧生成FeCl2 | |
| B. | 用pH试纸可测得氯水的pH值 | |
| C. | 溴化钠溶液中加入少量新制氯水振荡,再加入少量四氯化碳振荡,静置后,上层颜色变浅,下层颜色变橙红色 | |
| D. | 由Ca(ClO)2+CO2+H2O═CaCO3↓+2HClO,可推出Ca(ClO)2+SO2+H2O═CaCO3↓+2HClO |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 改变温度,当产物中NaClO3的物质的量最大时,发生的离子反应为:3Cl2+6OH-$\frac{\underline{\;\;△\;\;}}{\;}$5Cl-+ClO3-+3H2O | |
| B. | 某温度下,反应后若溶液中c(ClO-):c(ClO3-)=1:2,发生的离子反应为:7Cl2+14OH-$\frac{\underline{\;\;△\;\;}}{\;}$11Cl-+ClO-+2ClO3-+7H2O | |
| C. | 参加反应的Cl2与NaOH的物质的量的关系一定是a=0.5b | |
| D. | 改变温度,反应中转移电子的物质的量可能为b mol |
查看答案和解析>>
科目: 来源: 题型:选择题
| 选项 | 实验目的 | 实验方法 |
| A | 分离水和青蒿素 | 分液 |
| B | 分离乙醇和水 | 灼烧 |
| C | 分离碳酸钠和碳酸氢钠 | 过滤 |
| D | 除去碳酸钙中含有的少量氯化钙 | 萃取 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
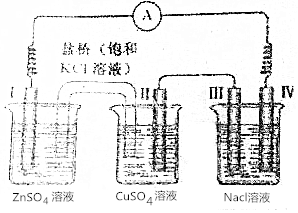
| A. | 电子由电极Ⅳ通过外电路流向电极Ⅰ | |
| B. | 装置工作过程中Ⅲ电极周围出现红色 | |
| C. | 电极Ⅱ发生还原反应 | |
| D. | 盐桥中Cl-向乙池移动 |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 将4gNaOH溶液溶入1L水中 | |
| B. | 常温下,将2.24LHCl气体溶于水配成1L溶液 | |
| C. | 含有4.9gH2SO4的溶液500mL | |
| D. | 将6.2gNa2O溶于水配成1L溶液 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | c(NaOH)>c(NH3•H2O) | |
| B. | c(Na+)=c(NH4+) | |
| C. | 等体积的NaOH与NH3•H2O溶液分别与足量的Si完全反应,NH3•H2O产生的H2多 | |
| D. | 用相同浓度的盐酸溶液分别与等体积的NaOH与NH3•H2O溶液恰好反应完全,NaOH消耗的盐酸溶液体积多 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com