
科目: 来源: 题型:解答题
| 时间/min | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | C1 | c2 | c3 | c3 |
| 4 | C1 | c2 | c3 | c3 |
| 5 | 0.116 | 0.216 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 |
查看答案和解析>>
科目: 来源: 题型:填空题
| Na2SO3 | Kal=1.54×l0-2 | Ka2=1.02×10-7 |
| HCIO | Ka1=2.95×10-8 | |
| H2CO3 | Kal=4.3×10-7 | Ka2=5.6×10-11 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | NaCl NaBr NaI | B. | NaCl NaBr | C. | NaCl NaI | D. | NaCl |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Na+、K+、OH-、Cl- | B. | Na+、Cu2+、SO42-、NO3- | ||
| C. | Mg2+、Na+、SO42-、Cl- | D. | Ca2+、HCO3-、NO3-、K+ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 运用蒸馏的方法,可以分离沸点相差较大的固体混合物 | |
| B. | 铁的化合物应用十分广泛,如FeCl3、FeSO4是优良的净水剂 | |
| C. | 镁燃烧发出耀眼的白光,常用于制造信号弹和焰火 | |
| D. | 工业上以氯气和石灰乳为原料制造漂白粉,漂白粉主要成分为Ca(ClO)2和CaCl2 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 标况下,22.4L的Cl2与足量水反应中电子转移了2NA | |
| B. | 0.1mol/LK2SO4溶液中含有0.2NA个阳离子 | |
| C. | 常温常压下,22.4LO2气体的分子数小于NA | |
| D. | 20g D2O所含的中子数为9NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 钠是一种强还原剂,可以将钛、铌等金属从其氯化物溶液中置换出来 | |
| B. | 铜能与氯化铁溶液反应,该反应可以应用于印刷电路板的制作 | |
| C. | 人们发现了118种元素,即共有118种核素 | |
| D. | H2和D2互为同位素 |
查看答案和解析>>
科目: 来源: 题型:实验题
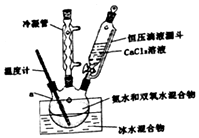 过氧化钙(CaO2)是一种白色结晶体粉末,极微溶于水,不溶于醇类、乙醚等,加热至150℃左右开始分解放出氧气,与水缓慢反应生成H2O2.易于酸反应生成H2O2
过氧化钙(CaO2)是一种白色结晶体粉末,极微溶于水,不溶于醇类、乙醚等,加热至150℃左右开始分解放出氧气,与水缓慢反应生成H2O2.易于酸反应生成H2O2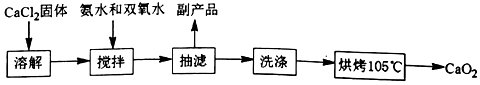
| 数据 时间 | 样品取用质量/(g) | 平均消耗体积(KMnO4)/mL |
| 放置前测定 | a | 25.00 |
| 放置一个月后测定 | a | 24.00 |
查看答案和解析>>
科目: 来源: 题型:解答题
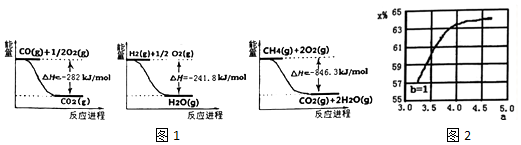
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com