
科目: 来源: 题型:选择题

| A. | ①说明水解反应为放热反应 | B. | ③说明水解反应为吸热反应 | ||
| C. | ①中溶液红色变浅 | D. | ③中溶液红色变深 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Na2S 溶液中 c(OH-)=c(H+)+c(HS-)+2c(H2S) | |
| B. | Na2CO3溶液中:c(Na+)=2c(CO32-)+2c(HCO3-) | |
| C. | 室温下,pH=1的CH3COOH溶液和pH=13的NaOH溶液等体积混合:溶液中离子浓度的大小顺序为:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | |
| D. | 0.1mol•L-1的NaHC2O4溶液的pH=4,则c(H C2O4-)>c(H+)>c(H2C2O4)>c(C2O42-) |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | c(Z)=0.4 mol/L | B. | c(X2)=0.2mol/L | ||
| C. | c(Y2)=0.4mol/L | D. | c(X2)+c(Y2)+c(Z)=0.6mol/L |
查看答案和解析>>
科目: 来源: 题型:解答题
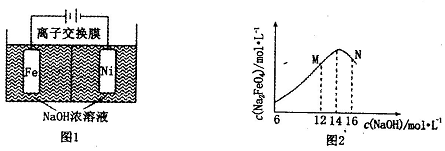
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 升高温度使化学反应速率增大的主要原因是增加了反应物分子中活化分子的百分数 | |
| B. | 有气体参加的化学反应,若增大压强(即缩小体积)可增加活化分子的百分数使化学反应速率增大 | |
| C. | 加入反应物,使活化分子的百分数增加,反应速率加快 | |
| D. | 活化分子间发生的碰撞为有效碰撞 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 2.24LCO2中含0.3NA原子 | |
| B. | 0.3molNH4NO3固体中含0.3NANH4+ | |
| C. | 5.6g铁粉完全反应一定失去0.3NA电子 | |
| D. | 25℃,0.1NAHCl气体溶于1L水,溶液pH=1 |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | a>7时,水溶液一定不是中性 | B. | a>7时,水的电离受到抑制 | ||
| C. | a<7时,溶液的pH一定为a | D. | a>7时,溶液的pH一定为14-a |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 在Na2CO3、NaHCO3两溶液中,离子种类不相同 | |
| B. | 在等体积、等物质的量浓度的Na2CO3、NaHCO两溶液中,阳离子总数相等 | |
| C. | 在Na2CO3溶液中一定有c(Na+)+c(H+)=c(HCO3-)+c(OH-)+2c(CO32-) | |
| D. | 在Na2CO3溶液中一定有c(Na+)>c(CO32-)>c(H+)>c(OH-) |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1mol/L乙酸溶液的pH值约为2 | |
| B. | 乙酸能与水以任何比例互溶 | |
| C. | 10mL1mol/L乙酸恰好与10mL1mol/LNaOH溶液完全反应 | |
| D. | 乙酸可以除去水垢 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com