
科目: 来源: 题型:实验题
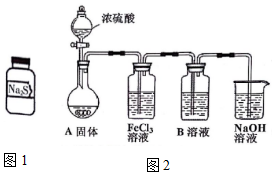 有两瓶标签已被腐蚀的药品,只看到“Na2S”字样(如图1),每瓶药品可能是Na2S、Na2SO3、Na2S2O3、Na2SiO3、Na2SO4中的一种.将两瓶药品分别标记为A、B,
有两瓶标签已被腐蚀的药品,只看到“Na2S”字样(如图1),每瓶药品可能是Na2S、Na2SO3、Na2S2O3、Na2SiO3、Na2SO4中的一种.将两瓶药品分别标记为A、B,查看答案和解析>>
科目: 来源: 题型:实验题
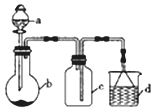
| 选项 | a中的物质 | b中的物质 | c中收集的气体 | d中的物质 |
| A | 稀硝酸 | Cu | NO | H2O |
| B | 稀H2SO4 | CaCO3 | CO2 | NaOH溶液 |
| C | 浓氨水 | NaOH固体 | NH3 | H2O |

| 称量 | 第1次 | 第2次 | 第3次 | 第4次 | 第5次 |
| 质量(g) | m1=5.4 | m2=8.2 | m3=7.4 | m4=7.2 | m5=7.2 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 甲烷的标准燃烧热为890.3 kJ•mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3 kJ•mol-1 | |
| B. | 已知2SO2(g)+O2(g)?2SO3(g)△H=-196.64kJ•mol-1,在容器中充入1mol SO2和0.5mol O2充分反应,放出的热量为98.32KJ | |
| C. | 已知在120C、101kPa时,1gH2燃烧生成水蒸气放出121KJ,其热化学方程式表示为H2(g)+$\frac{1}{2}$O2(g)=2H2O(l)△H=-242KJ/mol | |
| D. | CO(g) 的燃烧热是283.0kJ•mol-1,则CO2(g)=CO(g)+$\frac{1}{2}$O2(g)△H=+283kJ/mol |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 400 mL | B. | 600 mL | C. | 500 mL | D. | 480 mL |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | H2O2对Cu和稀硫酸的反应起催化作用 | |
| B. | 反应过程中的还原产物是SO2 | |
| C. | 若Cu和硫酸恰好完全反应,则原稀硫酸的物质的量浓度为0.75mol•L-1 | |
| D. | 反应过程中,还原剂和氧化剂的物质的量之比为1:2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com