
科目: 来源: 题型:解答题
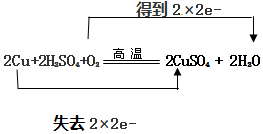 .
.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 5mol•L-1 | B. | 9mol•L-1 | C. | 11mol•L-1 | D. | 12mol•L-1 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 用湿润的pH试纸测稀碱液的pH,测定值偏大 | |
| B. | NaCl溶液和CH3COONH4溶液均显中性且两溶液中水的电离程度相同 | |
| C. | 用pH试纸测定次氯酸钠溶液的pH | |
| D. | 除去工业废水中的Cu2+可以选用FeS作沉淀剂 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
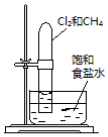 置于光亮处 置于光亮处 | 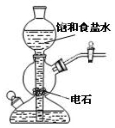 |
| A.验证甲烷与氯气发生化学反应 | B.实验室制乙炔 |
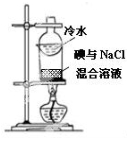 | 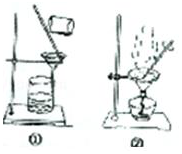 |
| C.从碘与氯化钠的混合溶液中分离碘 | D.粗苯甲酸的提纯 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 光照新制的氯水时,溶液的pH逐渐减小 | |
| B. | 棕红色的NO2加压后颜色先变深后变浅(已知:2NO2 (g)?N2O4 (g)) | |
| C. | 工业上生产硫酸的过程中,使用过量的空气以提高SO2的利用率 | |
| D. | 煅烧粉碎的硫铁矿利于SO2的生成 |
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 稀硫酸与氧化铜反应:O2-+2H+═H2O | |
| B. | 氯气溶于水:Cl2+H2O═2H++Cl-+ClO- | |
| C. | 碳酸钡与盐酸反应:BaCO3+2H+═Ba2++CO2↑+H2O | |
| D. | 向氯化钙溶液中通入CO2:Ca2++H2O+CO2═CaCO3↓+2H+ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | NH4+、Na+、CO32-、Cl- | B. | K+、Ba2+、Cl-、NO3- | ||
| C. | K+、Na+、OH-、SO42- | D. | Na+、Cu2+、Cl-、NO3- |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 2.4g镁变成Mg2+时失去的电子数目为0.2NA | |
| B. | 常温常压下,11.2L氧气所含的O原子数为NA | |
| C. | 如果11.2LN2中含有n个分子,则阿伏加德罗常数一定为2n | |
| D. | 1 mol•L-1的KSCN和1mol•L-1KAl(SO4)2溶液中,所含K+数都是NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com