
科目: 来源: 题型:解答题
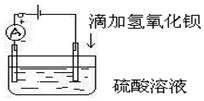 如图所示是某化学兴趣小组探究溶液中离子浓度与溶液导电性的关系.
如图所示是某化学兴趣小组探究溶液中离子浓度与溶液导电性的关系.查看答案和解析>>
科目: 来源: 题型:实验题
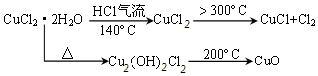
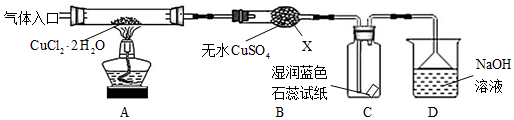
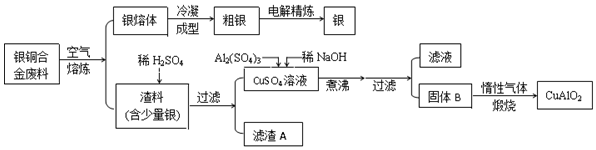
查看答案和解析>>
科目: 来源: 题型:实验题
| 实验步骤(简述操作过程) | 预期现象和结论 |
| ① ② ③ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 物质的量浓度为0.5 mol/L的MgCl2溶液,含有Cl- 个数为NA | |
| B. | V mL硫酸铁溶液中含有mg SO42-,则Fe3+的物质的量浓度为6.94m/V mol•L-1 | |
| C. | 将58.5 g NaCl溶解于1 L水中配成溶液,所得溶液的物质的量浓度为1 mol•L-1 | |
| D. | 用36.5%的浓盐酸(密度为1.25g•cm-3)配制成浓度为0.1mol•L-1的稀盐酸240mL,所需浓盐酸的体积为1.9mL |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 3.01×1023个双氢青蒿素的质量为142 g•mol-1 | |
| B. | 双氢青蒿素中的C、H、O三种元素的质量比45:6:20 | |
| C. | 7.1 g双氢青蒿素中含有的氢原子总数为1.2NA | |
| D. | 含有NA个碳原子的双氢青蒿素的物质的量为1 mol |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:实验题
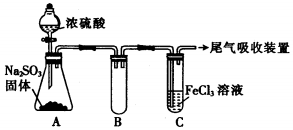
 已知:①、连二亚硫酸钠(Na2S2O4)是一种白色粉末,易溶于水,难溶于乙醇.②4HCl+2Na2S2O4═4NaCl+S↓+3SO2↑+2H2O某小组进行如下实验:
已知:①、连二亚硫酸钠(Na2S2O4)是一种白色粉末,易溶于水,难溶于乙醇.②4HCl+2Na2S2O4═4NaCl+S↓+3SO2↑+2H2O某小组进行如下实验:| 假设 | 操作 | 现象 | 原理 |
| Na2S2O4 为强 碱弱酸盐,其溶 液为碱性. | 取少量溶液于试管中, 滴加紫色水蕊试液 | 溶液变 成蓝色 | S2O42-水解,使溶液成碱性 |
| Na2S2O4 中 S为+3 价,具有较强 的还原性. | 取少量溶液于试管中, 滴加过量新制氯水,再 滴加 BaCl2 溶 | 有白色沉淀生 成 | 该反应的离子方程式为:4H2O+S2O42-+3Cl2=2SO42-+6Cl-+8H+ ,Ba2++SO42-=BaSO4↓; |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 在同一条件下不同物质有不同的熵值,其体系的混乱程度越大,熵值越大 | |
| B. | 焓变是一个反应能否自发进行相关的因素,多数放热反应能自发进行 | |
| C. | 一个反应能否自发进行,与焓变和熵变的共同影响有关 | |
| D. | 自发进行的反应一定能迅速进行 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 80mL | B. | 72mL | C. | 85mL | D. | 128mL |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 4.8mL | B. | 2.4mL | C. | 3mL | D. | 4mL或1.2mL |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com