
科目: 来源: 题型:推断题
查看答案和解析>>
科目: 来源: 题型:选择题
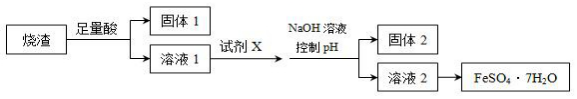
| A. | 溶解烧渣选用足量硫酸,试剂X选用铁粉 | |
| B. | 固体1中一定含有SiO2,控制pH为使Al3+转化为Al(OH)3,进入固体2 | |
| C. | 从溶液2得到FeSO4•7H2O产品的过程中,须控制条件防止其氧化 | |
| D. | 若改变方案,在溶液1中直接加NaOH至过量,得到的沉淀用硫酸溶解,其溶液经结晶分离也可得到FeSO4•7H2O |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 容量瓶用蒸馏水洗涤后未干燥即用来配制溶液 | |
| B. | 定容时,观察液面俯视刻度线 | |
| C. | 摇匀后,液面低于刻度线,没有再加蒸馏水 | |
| D. | 用蒸馏水洗涤烧杯和玻璃棒.并将洗涤液转移入容量瓶中 |
查看答案和解析>>
科目: 来源: 题型:选择题
| 起始浓度 | 甲 | 乙 | 丙 |
| c(H2)/mol•L-1 | 0.010 | 0.020 | 0.020 |
| c(CO2)/mol•L-1 | 0.010 | 0.010 | 0.020 |
| A. | 平衡时,乙中CO2的转化率大于60% | |
| B. | 平衡时,甲中和丙中H2的转化率均是60% | |
| C. | 平衡时,丙中c(CO2)是甲中的2倍,是0.012 mol•L-1 | |
| D. | 反应开始时,丙中的反应速率最快,甲中的反应速率最慢 |
查看答案和解析>>
科目: 来源: 题型:选择题
| 化学式 | 电离常数 |
| HClO | K1=3×10-8 |
| H2CO3 | K11=4.3×10-7 |
| K12=5.6×10-11 |
| A. | c(HCO3-)>c(ClO-)>c(OH-) | B. | c(ClO-)>c(HCO3-)>c(H+) | ||
| C. | c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3) | D. | c(Na+)+c(H+)=c(ClO-)+c(OH-)+c(HCO3-) |
查看答案和解析>>
科目: 来源: 题型:实验题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 在无色溶液中:Na+、Fe3+、NO3-、Cl- | |
| B. | pH=11的透明溶液中:Na+、K+、MnO4-、CO32- | |
| C. | 在含有HCO3-的溶液中:H+、K+、SO42-、Cl- | |
| D. | 含有大量Fe2+的溶液中:H+、K+、SO42-、NO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com