
科目: 来源: 题型:推断题
查看答案和解析>>
科目: 来源: 题型:解答题
| 化学式 | CH3COOH | HA | HNO2 | H2CO3 |
| Ka | Ka=1.8×10-5 | Ka=4.9×10-10 | Ka=4.6×10-4 | Ka1 =4.1×10-7 Ka2 =5.6×10-11 |
查看答案和解析>>
科目: 来源: 题型:解答题
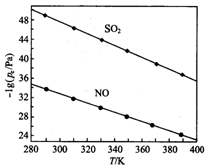 煤燃烧排放的烟气含有SO2和NOx,形成酸雨、污染大气,采用NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝,回答下列问题:
煤燃烧排放的烟气含有SO2和NOx,形成酸雨、污染大气,采用NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝,回答下列问题:| 离子 | SO42- | SO32- | NO3- | NO2- | Cl- |
| c/(mol•L-1) | 8.35×10-4 | 6.87×10-6 | 1.5×10-4 | 1.2×10-5 | 3.4×10-3 |
查看答案和解析>>
科目: 来源: 题型:填空题
 .
.查看答案和解析>>
科目: 来源: 题型:选择题
 25℃时,相同体积和pH的NaX、NaY、NaZ三种盐溶液,分别加水稀释,溶液pH的变化与所加水的体积关系如图所示.下列说法正确是( )
25℃时,相同体积和pH的NaX、NaY、NaZ三种盐溶液,分别加水稀释,溶液pH的变化与所加水的体积关系如图所示.下列说法正确是( )| A. | 在上述三种盐原溶液中,水的电离程度大小是NaX>NaY>NaZ | |
| B. | 在等物质的量浓度的NaX、NaY、NaZ混合液中,离子浓度的大小关系是c(Z-)>c(Y-)>c(X-) | |
| C. | 在上述NaX和NaY的混合液中存在$\frac{c(HX)}{c({X}^{-})}$=$\frac{c(HY)}{c({Y}^{-})}$ | |
| D. | 在0.2mol•L-1 NaX溶液中加 入等体积0.1mol•L-1的盐酸,所得混合液中存在c(H+)+c(HX)=c(OH-)+c(Cl-) |
查看答案和解析>>
科目: 来源: 题型:选择题
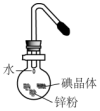 将碘研碎后与锌粉混合于蒸发皿中,然后滴加少量水,可观察到紫红色蒸气产生,此实验被称为“滴水生烟”.关于该实验的下列说法中错误的是( )
将碘研碎后与锌粉混合于蒸发皿中,然后滴加少量水,可观察到紫红色蒸气产生,此实验被称为“滴水生烟”.关于该实验的下列说法中错误的是( )| A. | Zn与I2的反应是放热反应 | B. | 水在该反应中作催化剂 | ||
| C. | 生成的碘化锌为紫红色 | D. | 紫红色的蒸气是碘升华所致 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 新制氯水盛放在棕色试剂瓶中,存放于低温避光的地方 | |
| B. | 液溴易挥发,盛放在用水液封、用橡皮胶塞密封的棕色试剂瓶中 | |
| C. | 碘易升华,盛放在棕色试剂瓶中 | |
| D. | 浓盐酸易挥发,盛装在无色密封的细口玻璃试剂瓶中 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 卤素是典型的非金属元素,其单质只具有氧化性而无还原性 | |
| B. | 卤素单质的熔点随相对分子质量的增大而升高 | |
| C. | 卤化银都不溶于水,也不溶于稍硝酸 | |
| D. | 卤化氢的水溶液都是强酸 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 金属单质在化学反应中只能做还原剂 | |
| B. | 非金属单质在化学反应中只能做氧化剂 | |
| C. | 金属原子在化学反应中失去的电子越多,其还原性就越强 | |
| D. | 置换反应不一定是氧化还原反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com