
科目: 来源: 题型:选择题
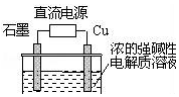 Cu2O是一种半导体材料,基于绿色化学理念设计的制取Cu2O的电解池示意图如图,电解总反应:2Cu+H2O$\frac{\underline{\;通电\;}}{\;}$Cu2O+H2↑.下列说法正确的是( )
Cu2O是一种半导体材料,基于绿色化学理念设计的制取Cu2O的电解池示意图如图,电解总反应:2Cu+H2O$\frac{\underline{\;通电\;}}{\;}$Cu2O+H2↑.下列说法正确的是( )| A. | 石墨电极上产生氧气 | |
| B. | 铜电极发生还原反应 | |
| C. | 铜电极接直流电源的正极 | |
| D. | 当有0.1mol电子转移时,有0.1molCu2O生成 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 过滤时,用玻璃棒搅动滤纸中的液体 | |
| B. | 做钠的焰色反应实验可用玻璃棒蘸取少量NaCl的浓溶液在无色火焰上灼烧 | |
| C. | 配制溶液过程中定容摇匀后发现液面低于容量瓶的刻度线,再用胶头滴管加水至刻度线 | |
| D. | 用自来水制蒸馏水时,弃去开始馏出的部分液体 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 热稳定性:Na2CO3>NaHCO3 | |
| B. | 相同温度时的水溶性:Na2CO3<NaHCO3 | |
| C. | 等物质的量浓度的溶液的碱性:Na2CO3<NaHCO3 | |
| D. | 与同浓度的盐酸反应的剧烈程度:Na2CO3>NaHCO3 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 胶体粒子的大小在1nm~1000nm之间 | |
| B. | 向沸水中逐滴加入少量饱和FeCl3溶液,可制得Fe(OH)3胶体 | |
| C. | 明矾在水中能生成氢氧化铝胶体,故可作净水剂 | |
| D. | 用光束照射CuSO4溶液不能观察到丁达尔效应 |
查看答案和解析>>
科目: 来源: 题型:多选题
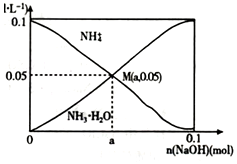 常温下,向1L0.lmol•L-1NH4Cl溶液中,不断加入固体NaOH后,NH4+与NH3•H20的变化趋势如图 所示(不考虑溶液体积的变化和氨的挥发),下列说法正确的是( )
常温下,向1L0.lmol•L-1NH4Cl溶液中,不断加入固体NaOH后,NH4+与NH3•H20的变化趋势如图 所示(不考虑溶液体积的变化和氨的挥发),下列说法正确的是( )| A. | M点溶液中水的电离程度比原溶液大 | |
| B. | 在 M 点时,n(OH- )-n(H+)=(a-0.05)mol | |
| C. | 当n(NaOH)=0.05mol时溶液中有:c(Cl-)>c(Na+)>c( NH4+)>c(OH-)>c(H+) | |
| D. | 随着NaOH的加入,一定存在c(Cl-)+c(0H-)+c(NH3•H20)>0.lmol•L-1 |
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 0.1 mol•L-1Na2S溶液与0.1 mol•L-1NaHS溶液等体积混合:2c(H2S)═3c(Na+)-2c(HS-)-2c(S2-) | |
| B. | 0.1 mol•L-1氨水与0.05 mol•L-1盐酸等体积混合:c(OH-)+c (NH3•H2O)═c(Cl-)+c(H+) | |
| C. | pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合:c(CH3COOH)+c(H+)>c(OH-)+c(Na+) | |
| D. | 浓度均为0.1 mol•L-1的NH4HSO4溶液与NaOH溶液等体积混合:c(Na+)=c(SO${\;}_{4}^{2-}$)>c(NH${\;}_{4}^{+}$)>c(OH-)>c(H+) |
查看答案和解析>>
科目: 来源: 题型:选择题
| 选项 | 操作 | 现象 | 结论 |
| A | 用洁净铂丝蘸取溶液进行焰色反应 | 火焰呈黄色 | 原溶液中有Na+无K+ |
| B | 常温下将Al片放入浓硝酸中 | 无明显变化 | Al与浓硝酸不反应 |
| C | 无色溶液中滴加氯水和CC14,振荡、静置 | 下层溶液呈紫色 | 原溶液中有I- |
| D | 将水蒸气通过灼热的铁粉 | 粉末变红 | 铁与水高温下反应 |
| A. | A、 | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com