
科目: 来源: 题型:解答题

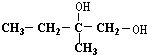 +O2$→_{△}^{Cu}$2
+O2$→_{△}^{Cu}$2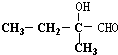 +2H2O.
+2H2O. $→_{△}^{浓H_{2}SO_{4}}$CH3CH=C(CH3)COOH+H2O.
$→_{△}^{浓H_{2}SO_{4}}$CH3CH=C(CH3)COOH+H2O.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 将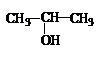 与NaOH的水溶液共热制备CH3-CH═CH2 与NaOH的水溶液共热制备CH3-CH═CH2 | |
| B. | 用甲苯与稀硝酸、稀硫酸的混合酸相混制取TNT | |
| C. | 甲苯在溴化铁催化作用下与液溴反应生成2,4,6-三溴甲苯 | |
| D. | 向CH3CH2Br中滴入AgNO3溶液就可以检验溴元素 |
查看答案和解析>>
科目: 来源: 题型:选择题
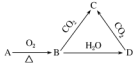
| A. | C与CO2能继续反应 | B. | 与澄清石灰水反应产生白色沉淀 | ||
| C. | 与足量盐酸反应放出气体 | D. | 受热易分解 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 生成1mol ClO2,转移电子数为2NA | B. | 该反应为复分解反应 | ||
| C. | H2SO4发生氧化反应 | D. | NaClO3是氧化剂 |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 用铜做电极电解CuSO4溶液:2Cu2++2H2O=2Cu↓+O2↑+4H+ | |
| B. | 惰性电极电解MgCl2溶液:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+Cl2↑+H2↑ | |
| C. | 乙醛溶液中加入新制碱性Cu(OH)2悬浊液并加热CH3CHO+2 Cu(OH)2+OH-$\stackrel{△}{→}$ CH3COO-+Cu2O↓+3H2O | |
| D. | 硝酸银溶液中滴加过量氨水:Ag++NH3•H2O═AgOH↓+NH4+ |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 0.1mol•L-1CH3COONa溶液与0.1mol•L-1CaCl2溶液等体积混合:c(Na+)+2c(Ca2+)═c(CH3COO-)+c(CH3COOH)+c(Cl-) | |
| B. | 浓度均为0.1mol•L-1的小苏打溶液与烧碱溶液等体积混合:c(OH-)-c(H+)═c(HCO3-)+c(H2CO3) | |
| C. | pH相同的氨水、KOH溶液、Ba(OH)2溶液中:c(NH4+)<c(K+)═2c(Ba2+) | |
| D. | 常温下,0.2mol•L-1NH4NO3溶液与0.1mol•L-1NaOH溶液等体积混合,所得pH═9.6的溶液中:c(NO3-)>c(Na+)>c(NH4+)>c(NH3•H2O)>c(OH-)>c(H+) |
查看答案和解析>>
科目: 来源: 题型:解答题
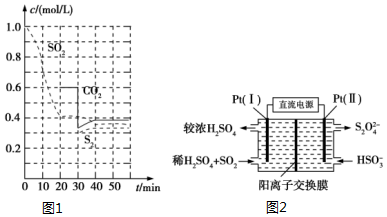 SO2直接排放会对环境造成危害.SO2的尾气处理通常有以下几种方法:
SO2直接排放会对环境造成危害.SO2的尾气处理通常有以下几种方法:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com