
科目: 来源: 题型:选择题
| A. | a<b | B. | a>b | C. | a=b | D. | 2b=a |
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | pH=2的HA溶液与pH=12的MOH碱溶液以任意比混合:c(H+)+c(M+)═c(OH-)+c(A-) | |
| B. | 0.1mol•L-1Na2SO3溶液:c(Na+)=c(SO32-)+c(HSO3-)+c(H2SO3) | |
| C. | 等浓度、等体积的Na2CO3和NaHCO3混合溶液:$\frac{c{(HCO}_{3}^{-})}{c({H}_{2}C{O}_{3})}>$$\frac{c{(CO}_{3}^{2-})}{c{(HCO}_{3}^{-})}$ | |
| D. | 0.1mol•L-1CH3COONa溶液与0.1mol•L-1CaCl2溶液等体积混合:c(Na+)+c(Ca2+)=c(CH3COO-)+c(CH3COOH)+2c(CL-) |
查看答案和解析>>
科目: 来源: 题型:选择题
| 容器编号 | 温度/℃ | 起始物质的量/mol | 平衡物质的量/mol | ||
| H2 | SO2 | H2 | SO2 | ||
| 容器Ⅰ | 300 | 0.3 | 0.1 | / | 0.02 |
| 容器Ⅱ | 300 | 0.6 | 0.2 | / | / |
| 容器Ⅲ | 240 | 0.3 | 0.1 | / | 0.01 |
| A. | 该反应的正反应吸热 | |
| B. | 到达平衡时,容器Ⅰ中SO2的转化率比容器Ⅱ的大 | |
| C. | 240℃时,该反应的平衡常数为1.08×104 | |
| D. | 到达平衡时,容器Ⅲ中的正反应速率比容器Ⅰ中的大 |
查看答案和解析>>
科目: 来源: 题型:解答题
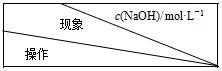 | 5.0 | 6.0 | 7.0 |
| 实验Ⅰ:滴入几滴KSCN溶液 | 不变红 | 不变红 | 不变红 |
| 实验Ⅱ:先加入过量稀硫酸,再滴入几滴KSCN溶液 | 不变红 | 变红 | 变红 |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:填空题
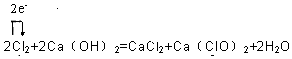 ,并用单线桥表示该反应电子转移的方向和数目.
,并用单线桥表示该反应电子转移的方向和数目. (任填一种物质的电子式)
(任填一种物质的电子式)查看答案和解析>>
科目: 来源: 题型:多选题
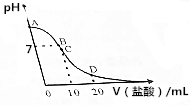 25℃,在20mL0.1mol•L-1氨水溶液中逐滴加入0.2mol•L-1HCl溶液,溶液的pH与所加盐酸的体积关系如图所示,已知0.1mol•L-1氨水的电离度为1.32%.下列说法不正确的是( )
25℃,在20mL0.1mol•L-1氨水溶液中逐滴加入0.2mol•L-1HCl溶液,溶液的pH与所加盐酸的体积关系如图所示,已知0.1mol•L-1氨水的电离度为1.32%.下列说法不正确的是( )| A. | 在A点处的溶液中pH<12 | B. | 在B点:c(NH4+)=c(Cl-)>c(OH-)>c(H+) | ||
| C. | 在C点:c(Cl-)>c(NH4+)>c(H+)>c(OH-) | D. | 在D点:c(NH4+)+c(NH3•H2O)=2c(Cl-) |
查看答案和解析>>
科目: 来源: 题型:解答题
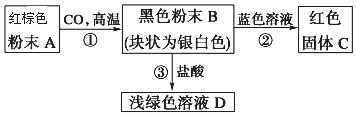
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com