
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1:1:1 | B. | 4:2:1 | C. | 2:3:4 | D. | 6:3:2 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 2.12 g | B. | 4.24 g | C. | 3.18 g | D. | 5.28 g |
查看答案和解析>>
科目: 来源: 题型:实验题
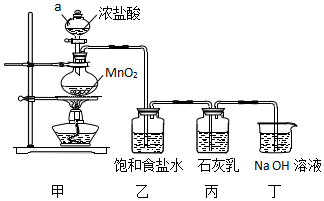
查看答案和解析>>
科目: 来源: 题型:实验题
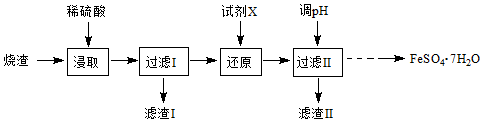
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1:1:1 | B. | 1:2:3 | C. | 3:1:1 | D. | 6:3:2 |
查看答案和解析>>
科目: 来源: 题型:选择题
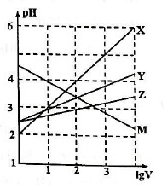 常温下取0.1mol•L-1的NaA和NaB两种盐溶液各1L,分别通入0.02mol CO2,发生如下反应:NaA+CO2+H2O?HA+NaHCO3、2NaB+CO2+H2O?2HB+Na2CO3.则HA和HB的1L溶液分别加水稀释至体积为VL时可能有如下的曲线,则下列说法正确的是( )
常温下取0.1mol•L-1的NaA和NaB两种盐溶液各1L,分别通入0.02mol CO2,发生如下反应:NaA+CO2+H2O?HA+NaHCO3、2NaB+CO2+H2O?2HB+Na2CO3.则HA和HB的1L溶液分别加水稀释至体积为VL时可能有如下的曲线,则下列说法正确的是( )| A. | X是HA,M是HB | |
| B. | 常温下PH:NaA溶液>NaB溶液 | |
| C. | 对于$\frac{c({R}^{-})}{c(HR)c(O{H}^{-})}$的值(R代表A或B),一定存在HA>HB | |
| D. | 若常温下浓度均为0.1mol•L-1的NaA和HA的混合溶液的PH>7,则c(A-)>c(HA) |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 浓度均为0.2mol•L-1的 Na2CO3、NaHCO3混合溶液:2c(Na+)=3[c(CO32-)+c(HCO3-)] | |
| B. | 浓度相等的a、NH4HSO4溶液、b、NH4HCO3溶液、c、NH4Cl溶液中的c(NH4+):a>b>c | |
| C. | NaHSO3溶液显酸性,c(Na+)>c(HSO3- )>c(H+)>c(OH-)>c(SO32-) | |
| D. | pH=3.6 的0.lmol/LHX 与0.lmol/LNaX 的混合溶液中,2c(H+)-2c(OH-)=c(X-)-c(HX) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com