
科目: 来源: 题型:解答题
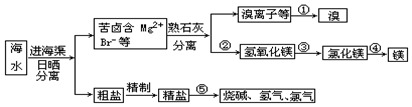
查看答案和解析>>
科目: 来源: 题型:解答题
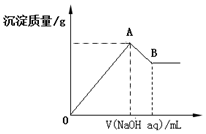 在含有0.60molCl-、0.80molSO42-及一定量Mg2+和Al3+的混合溶液中,滴入一定浓度NaOH溶液,产生沉淀情况如图(不考虑Mg2+和Al3+水解及水电离对离子数目的影响).若反应前Al3+的物质的量为a mol,Al3+的物质的量与混合溶液中离子总物质的量的比值为x.
在含有0.60molCl-、0.80molSO42-及一定量Mg2+和Al3+的混合溶液中,滴入一定浓度NaOH溶液,产生沉淀情况如图(不考虑Mg2+和Al3+水解及水电离对离子数目的影响).若反应前Al3+的物质的量为a mol,Al3+的物质的量与混合溶液中离子总物质的量的比值为x.查看答案和解析>>
科目: 来源: 题型:选择题
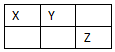 X、Y、Z、W是元素周期表前四周期元素,X、Y、Z是短周期元素,它们在周期表中的位置关系如图所示,其中Y原子的最外层电子数是电子层数的3倍.W的原子总数是Z的2倍.下列说法不正确的是( )
X、Y、Z、W是元素周期表前四周期元素,X、Y、Z是短周期元素,它们在周期表中的位置关系如图所示,其中Y原子的最外层电子数是电子层数的3倍.W的原子总数是Z的2倍.下列说法不正确的是( )| A. | W位于元素周期表第四周期ⅥA族 | |
| B. | X、W、Z的最高正化合价依次升高 | |
| C. | X、Y、Z三种元素都能与氢形成18电子化合物 | |
| D. | 简单离子半径:W>Y>X>Z |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 原子半径:Z>Y>X | |
| B. | 最高价氧化物对应水化物的酸性:Z>X | |
| C. | 最简单氢化物的稳定性:W<Z<X | |
| D. | Y的氧化物不属于两性氧化物 |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
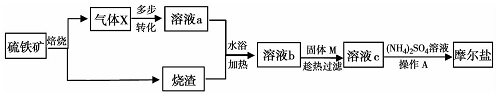
 亚硝酸钠(NaNO,)被称为工业盐,在漂白、电镀等方面应用广泛.以木炭、浓硝酸、水和过氧化钠为原料制备亚硝酸钠的装置如图所示.
亚硝酸钠(NaNO,)被称为工业盐,在漂白、电镀等方面应用广泛.以木炭、浓硝酸、水和过氧化钠为原料制备亚硝酸钠的装置如图所示.查看答案和解析>>
科目: 来源: 题型:解答题
| 可能与某类物质反应 | 具体的离子反应方程式 | |
| CuCl2 | 金属单质 | ①Cu2++Fe=Cu+Fe2+ |
| ②氢氧化钠 | ③Cu2++2OH-=Cu(OH)2↓ | |
| ④硝酸银 | Ag++Cl-═AgCl↓ |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com