
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 9.2mol/L | B. | 大于9.2mol/L | C. | 小于9.2mol/L | D. | 无法确定 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Ba(OH)2与MgSO4反应:Mg2++2OH-=Mg(OH)2↓ | |
| B. | 盐酸滴在石灰石上:CO32-+2H+═CO2↑+H2O | |
| C. | 硫酸铝溶液与氯化钡溶液混合:Ba2++SO42-═BaSO4↓ | |
| D. | 碳酸钙溶于稀醋酸中:CaCO3+2H+═Ca2++H2O+CO2↑ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 150mL1mol•L-1NaCl溶液 | B. | 75mL1mol•L-1CaCl2溶液 | ||
| C. | 150mL1mol•L-1KCl溶液 | D. | 75mL1mol•L-1AlCl3溶液 |
查看答案和解析>>
科目: 来源: 题型:选择题
| 加入物质 | 结论 | |
| A | 100mLH2O | 由水电离出的c(H+)•c(OH-)减小 |
| B | 0.01molK2O | 溶液中$\frac{{c({HC{O^-}})}}{{c({O{H^-}})}}$增大 |
| C | 50mLmol•L-1H2SO4 | 反应结束后,c(K+)=c(SO42-) |
| D | 0.1molKHSO4固体 | 反应结束构,溶液的pH=7 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 相同条件下,SO2(g)和O2(g)所具有的能量大于SO3(g)所具有的能量 | |
| B. | 将2molSO2(g)和O2(g)置于某密闭容器中充分反应,放出热量为QkJ | |
| C. | 增大压强或升高温度,该平衡都向正反应方向移动 | |
| D. | 若将一定量SO2(g)和O2(g)置于某密闭容器中充分反应后放热QkJ,则此过程有2molSO2(g)被氧化 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Kb(NH3•H2O) | B. | n(OH-) | C. | $\frac{{c({N{H_3}•{H_2}O})}}{{c({O{H^-}})}}$ | D. | $\frac{{c({O{H^-}})}}{{c({NH_4^+})}}$ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1s | B. | 3s | C. | 10s | D. | 30s |
查看答案和解析>>
科目: 来源: 题型:解答题
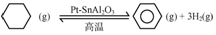
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com