
科目: 来源: 题型:解答题
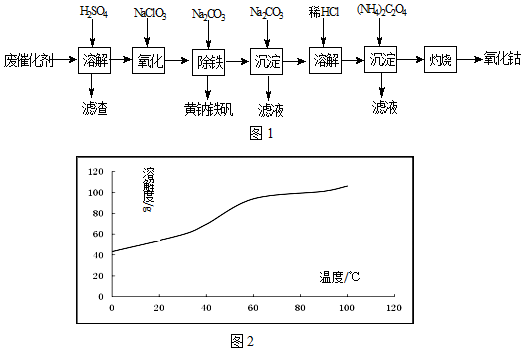
查看答案和解析>>
科目: 来源: 题型:实验题
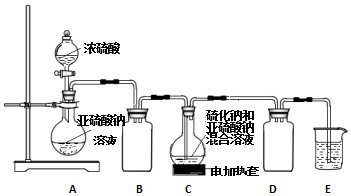
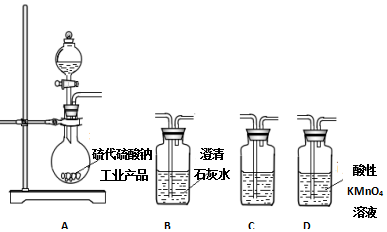
查看答案和解析>>
科目: 来源: 题型:选择题
| 容器 | 甲 | 乙 | 丙 |
| 反应物的投入量 | 3molH2、2molN2 | 6molH2、4molN2 | 2molNH3 |
| 平衡时N2的浓度/mol•L-1 | c1 | 1.5 | |
| NH3的体积分数 | ω2 | ω3 | |
| 混合气体的密度/g•L-1 | ρ1 | ρ3 |
| A. | 2c1<1.5 | |
| B. | ρ1=ρ3 | |
| C. | ω2=2ω3 | |
| D. | 在该温度下甲容器中反应的平衡常数K=$\frac{(2-2{c}_{1})^{2}}{{c}_{1}(3c-1.5)^{3}}$ |
查看答案和解析>>
科目: 来源: 题型:选择题
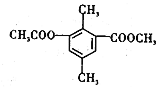
| A. | 分子中不同化学环境的氢共有4种 | |
| B. | 分子中所有的碳原子不可能共平面 | |
| C. | lmol该有机物与足量NaOH溶液反应,最多消耗3mol NaOH | |
| D. | 能发生取代、消去、加成和氧化反应 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 标准状况下,5.6L二氧化碳气体中含有的氧原子数为0.5NA | |
| B. | 0.1L0.5mol/LCH3COOH溶液中含有的氢离子数为0.05NA | |
| C. | 1molFe溶于过量硝酸,电子转移数为2NA | |
| D. | 标准状况下,2.24LCC14含有的共价键数为0.4NA |
查看答案和解析>>
科目: 来源: 题型:解答题
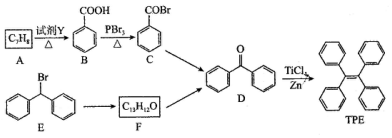
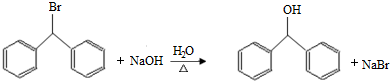 .
.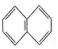 )的一元取代物;②存在羟甲基(-CH2OH).写出W所有可能的结构简式
)的一元取代物;②存在羟甲基(-CH2OH).写出W所有可能的结构简式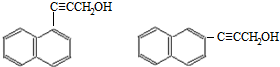 .
.查看答案和解析>>
科目: 来源: 题型:解答题
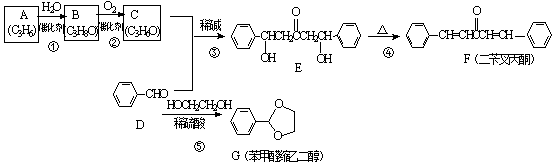
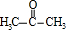 ;A加聚产物的结构简式是
;A加聚产物的结构简式是 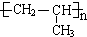 .
.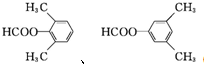 .
.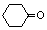 (环已酮)合成
(环已酮)合成 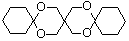 [已知HCHO是所有醛中还原性最强的(常用Ca(OH)2催化剂)]
[已知HCHO是所有醛中还原性最强的(常用Ca(OH)2催化剂)]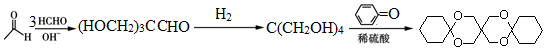 .
.查看答案和解析>>
科目: 来源: 题型:推断题
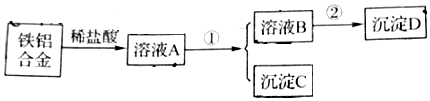
查看答案和解析>>
科目: 来源: 题型:解答题
| 实验 序号 | 试剂体积 V/mL | 显色时间 t/s | ||||
| K2S2O8溶液 | KI溶液 | 水 | Na2S2O3溶液 | 淀粉溶液 | ||
| ① | 10 | 10 | 0 | 4 | 1 | 26.8 |
| ② | 5 | 10 | 5 | 4 | 1 | 54.0 |
| ③ | 2.5 | 10 | V1 | 4 | 1 | 108.2 |
| ④ | 10 | 5 | 5 | 4 | 1 | 53.8 |
| ⑤ | 5 | 7.5 | 7.5 | 4 | V2 | t1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com