
科目: 来源: 题型:解答题
| 化学式 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| Kaq | 8.0×10-16 | 8.0×10-18 | 8.0×10-20 |
查看答案和解析>>
科目: 来源: 题型:解答题
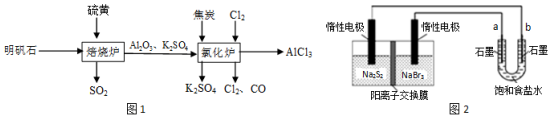
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 能与NaOH溶液反应的同分异构体共有6种 | |
| B. | 存在分子中含有六元环的同分异构体 | |
| C. | 既含有羟基又含有醛基的有5种 | |
| D. | 不存在含有2个羟基的同分异构体 |
查看答案和解析>>
科目: 来源: 题型:实验题
查看答案和解析>>
科目: 来源: 题型:实验题
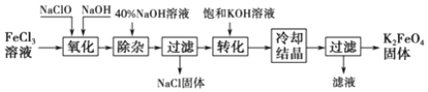
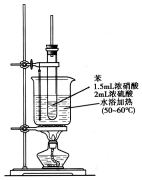 纯硝基苯是一种具有苦杏仁气味的无色油状液体,密度比水大,是制造染料的重要原料,实验室用如图所示的装置来制取.
纯硝基苯是一种具有苦杏仁气味的无色油状液体,密度比水大,是制造染料的重要原料,实验室用如图所示的装置来制取.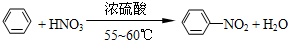 .
.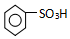 ),导致硝基苯的产率下降.写出发生副反应的化学方程式
),导致硝基苯的产率下降.写出发生副反应的化学方程式 +H2SO4(浓)$\stackrel{△}{→}$
+H2SO4(浓)$\stackrel{△}{→}$ +H2O.
+H2O.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 氯气与紫色石蕊溶液--先变红后褪色 | |
| B. | 过量的Cl2与KI淀粉溶液--变蓝 | |
| C. | SO2与紫色石蕊溶液--变红 | |
| D. | 硫化氢与湿润的醋酸铅试纸--变黑 |
查看答案和解析>>
科目: 来源: 题型:解答题
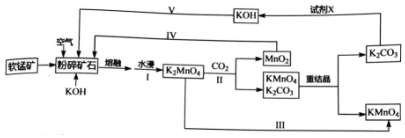
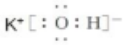 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com