
科目: 来源: 题型:多选题
| A. | 通入氯气后的溶液中一定不存在I- | |
| B. | 通入氯气之后原溶液中的Fe2+全部被氧化 | |
| C. | 原溶液中的Br-不可能被氧化 | |
| D. | 若取少量所得溶液,再加入CCl4溶液充分振荡,静置、分液,下层溶液可能呈紫红色 |
查看答案和解析>>
科目: 来源: 题型:推断题
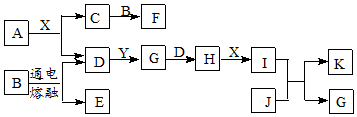
查看答案和解析>>
科目: 来源: 题型:选择题
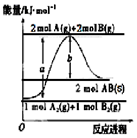
| A. | 该反应热△H=+(a-b)kJ•mol-1 | |
| B. | AB(g)═A(g)+B(g)△H=+b/2kJ•mol-1 | |
| C. | 断裂1 mol A-A键和1 mol B-B键,吸收a kJ能量 | |
| D. | 该反应在任何条件下都不可能自发进行 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 点燃爆竹后,硫燃烧生成SO3 | |
| B. | 中国古代利用明矾溶液的酸性清除铜镜表面的铜锈 | |
| C. | 服用阿司匹林出现水杨酸反应时,用NaHCO3溶液解毒 | |
| D. | 高铁车厢大部分材料采用铝合金,因为铝合金强度大、质量轻、抗腐蚀能力强 |
查看答案和解析>>
科目: 来源: 题型:解答题
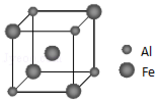
查看答案和解析>>
科目: 来源: 题型:解答题
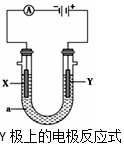 电解原理在化学工业中有广泛应用.根据如图装置,回答以下问题:
电解原理在化学工业中有广泛应用.根据如图装置,回答以下问题:| 方案 | X | Y | a溶液 |
| A | 银 | 石墨 | AgNO3 |
| B | 银 | 铁 | AgNO3 |
| C | 铁 | 银 | Fe(NO3)3 |
| D | 铁 | 银 | AgNO3 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Cu(OH)2 和盐酸; Cu(OH)2 和 CH3COOH | |
| B. | BaCl2 和 Na2SO4; Ba(OH)2 和 CuSO4 | |
| C. | NaHCO3 和 NaHSO4; Na2CO3 和 NaHSO4 | |
| D. | NaHCO3(过量) 和 Ca(OH)2; Ca(HCO3)2 和 NaOH(过量) |
查看答案和解析>>
科目: 来源: 题型:实验题
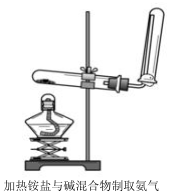 实验室一般采用如下装置制取氨气,按要求回答下列问题:
实验室一般采用如下装置制取氨气,按要求回答下列问题:查看答案和解析>>
科目: 来源: 题型:实验题
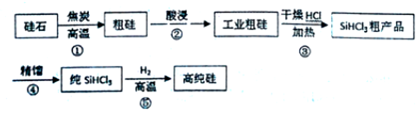
查看答案和解析>>
科目: 来源: 题型:解答题
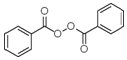 也被禁用. 下面是一种以苯为原料合成过氧化苯甲酰的流程:
也被禁用. 下面是一种以苯为原料合成过氧化苯甲酰的流程: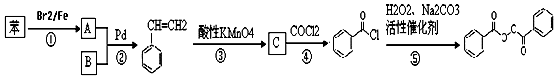
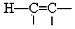 $\stackrel{Pd}{→}$
$\stackrel{Pd}{→}$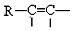
 ;
;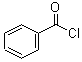 +H2O2$\frac{\underline{\;催化剂\;}}{碳酸钠}$
+H2O2$\frac{\underline{\;催化剂\;}}{碳酸钠}$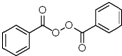 +2HCl;
+2HCl;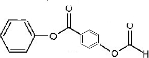 、
、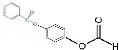 ;
; ;
; 的流程,无机物任选,注明反应条件.
的流程,无机物任选,注明反应条件.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com