
科目: 来源: 题型:选择题
| 选项 | 实验操作和现象 | 结论 |
| A | 向氢氧化镁的饱和溶液中滴加FeCl3溶液,出现红褐色沉淀 | Ksp[Mg(OH)2]>Ksp[Fe(OH)3] |
| B | 等浓度的Na2CO3和Na2SO3溶液的pH,前者>后者 | 非金属性S>C |
| C | 金属镁片和铝片用灵敏电流计相连,伸入烧碱溶液中,发现镁片上有气泡 | 金属性Mg<A1 |
| D | 冰醋酸中加入水,氢离子浓度先增大,后减小 | 醋酸的电离程度先增大后减小 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 用干燥的PH试纸可以确定某气体是否是氨气 | |
| B. | 在含有FeCl2杂质的FeCl3溶液中通入足量Cl2后,充分加热,可得到纯净的FeCl3溶液 | |
| C. | 中和热测定实验中,碱液要一次性加入,以防止热量损失 | |
| D. | 为减小中和滴定误差,锥形瓶必须用待测液润洗后才能使用 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 亚硫酸氢钠的水解:HSO3-+H2O?H3O++SO32- | |
| B. | 甲烷燃料电池(电解质为KOH)负极反应:CH4-8e-+2H2O═CO2+8H+ | |
| C. | 1mol•L-1 NH4A1(SO4)2溶液中逐滴加入等体积4 mol•L-1 NaOH溶液:Al3++4OH-═AlO2-+2H2O | |
| D. | 用硫酸铜溶液去除硫化氢气体Cu2++H2S═CuS↓+2H+ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | NaX溶液的pH>7,则可证明HX属于弱电解质 | |
| B. | 二氯化铁溶液可以做电子工业中铜版的刻蚀液 | |
| C. | 实验室盛放NaF溶液不能用玻璃材质的试剂瓶及玻璃塞 | |
| D. | 浓的硫化钠溶液有强烈的臭味 |
查看答案和解析>>
科目: 来源: 题型:解答题
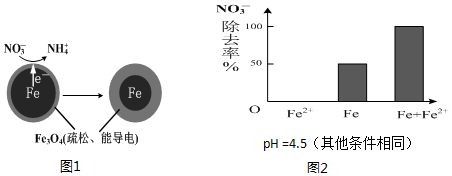 用零价铁(Fe)去除水体中的硝酸盐(NO3-)已成为境修复研究的热点之一.
用零价铁(Fe)去除水体中的硝酸盐(NO3-)已成为境修复研究的热点之一.| 初始pH | pH=2.5 | pH=4.5 |
| NO3-的去除率 | 接近100% | <50% |
| 24小时pH | 接近中性 | 接近中性 |
| 铁的最终物质形态 | 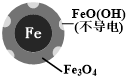 | 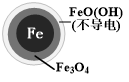 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 用FeSO4除去酸性废水中的Cr2O72-:Cr2O72-+6 Fe2++14H+═2Cr3++6 Fe3++7H2O | |
| B. | NH4Al(SO4)2溶液中加入少量的氢氧化钠溶液:Al3++3OH-═Al(OH)3↓ | |
| C. | 用惰性电极电解MgCl2溶液2H2O+2Cl-$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2OH- | |
| D. | 用CaSO4治理盐碱地:CaSO4(s)+Na2CO3(aq)?CaCO3(s)+Na2SO4(aq) |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 无色透明的溶液:H+、Al3+、NH4+、NO3-、K+ | |
| B. | FeCl3溶液中:K+、Na+、SCN-、Cl- | |
| C. | 能使淀粉KI试纸显蓝色的溶液中:K+、SO42-、S2-、SO32- | |
| D. | 含有0.1 mol•L-1 HCO3-的溶液:Na+、Fe3+、NO3-、SO42- |
查看答案和解析>>
科目: 来源: 题型:填空题
 .该反应中氧化剂为HNO3,被还原的元素是N,每生成3.36L标准状况下的气体,转移电子数目为0.45NA(或2.709×1023).
.该反应中氧化剂为HNO3,被还原的元素是N,每生成3.36L标准状况下的气体,转移电子数目为0.45NA(或2.709×1023).查看答案和解析>>
科目: 来源: 题型:实验题
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com