
科目: 来源: 题型:选择题
| 元素代号 | X | Y | Z | W |
| 原子半径/nm | 0.160 | 0.143 | 0.075 | 0.074 |
| 主要化合价 | +2 | +3 | +5,+3,-3 | -2 |
| A. | X.Y元素的金属性X>Y | B. | Z,W元素的非金属性Z>W | ||
| C. | Y,W形成的化合物具有两性 | D. | Z的氢化物为一种碱性气体 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 将稀释的硫酸溶液转移至容量瓶后,未洗涤烧杯和玻璃棒 | |
| B. | 将烧杯内的稀硫酸向容量瓶中转移时,因操作不当使部分稀硫酸溅出瓶外 | |
| C. | 用胶头滴管向容量瓶中加水时溶液凹面高于容量瓶刻度,此时立即用滴管将瓶内液体吸出,使溶液凹液面与刻度相切 | |
| D. | 用胶头滴管加水时,俯视观察溶液凹液面与容量瓶刻度相切 |
查看答案和解析>>
科目: 来源: 题型:解答题
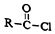 +R′-NH2→
+R′-NH2→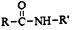 +HCl
+HCl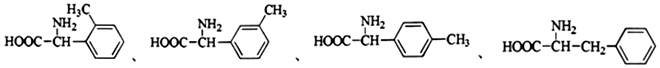 .
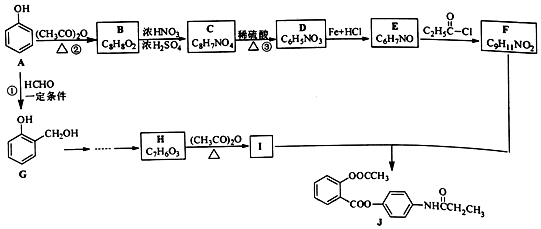
.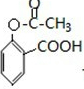 ;合成过程中设计步骤②和③的目的是保护酚羟基不被氧;
;合成过程中设计步骤②和③的目的是保护酚羟基不被氧;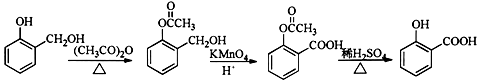 .
. .
.查看答案和解析>>
科目: 来源: 题型:实验题
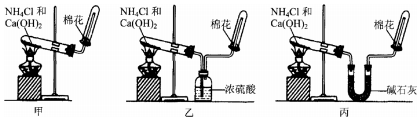
查看答案和解析>>
科目: 来源: 题型:解答题
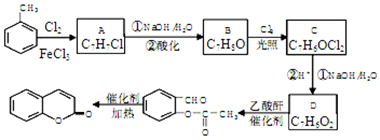
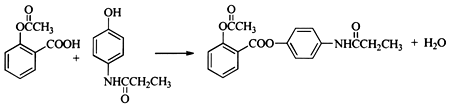
 ,A→B的反应类型是取代反应.
,A→B的反应类型是取代反应.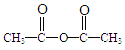 )反应,除生成
)反应,除生成 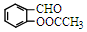 外,同时生成的另一种产物的结构简式是CH3COOH.
外,同时生成的另一种产物的结构简式是CH3COOH.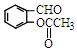 互为同分异构体,且具有以下特点:
互为同分异构体,且具有以下特点:查看答案和解析>>
科目: 来源: 题型:选择题
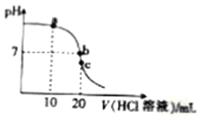
| A. | a点对应的溶液中,c(Cl-)>c(NH4+ )>c(OH- )>c(H+ ) | |
| B. | b点对应的溶液中,c(NH4+)>c(Cl-),c(OH- )=c(H+ ) | |
| C. | c点对应的溶液中,c(H+)=c(NH3•H2O)+c(OH- ) | |
| D. | 滴定过程中可能出现:c(NH4+ )>c(OH- )>c(H+ )>c(Cl-) |
查看答案和解析>>
科目: 来源: 题型:选择题
| 电池 | 电解池 | |
| A | H+移向Pb电极 | H+移向Pb电极 |
| B | 每消耗6molPb] | 生成2molAl2O3 |
| C | 正极:PbO2+4H++2e-=Pb2++2H2O | 阳极:2Al+3H2O-6e-=Al2O3+6H+ |
| D | Pb电极反应质量不变 | Pb电极反应质量不变 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:实验题
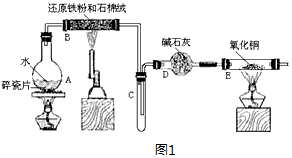

查看答案和解析>>
科目: 来源: 题型:实验题
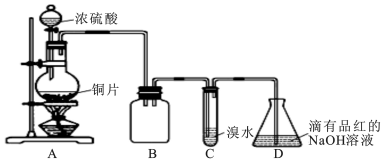
| 序号 | 实验操作 | 预期现象及结论 |
| ① | 取上述混合溶液于试管A中,加入少量CaCO3固体,充分振荡. | 若固体溶解,产生气泡,则Ⅰ或Ⅱ成立. |
| ② | 继续向试管A中滴加溴水,充分振荡. | 若溶液褪色,结合步骤①,则Ⅱ成立;若溶液不褪色,结合步骤①,则Ⅰ成立 |
| ③ | 另取上述混合溶液于试管B中,滴加几滴淀粉KI溶液,充分振荡. | 溶液变为蓝色,则Ⅲ成立. |
查看答案和解析>>
科目: 来源: 题型:选择题
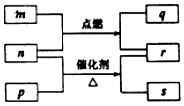 短周期元素W、X、Y、Z的原子序数依次增大.m、p、q、r、s是由这些元素组成的二元化合物,常温常压下r 为液体,其余均为无色气体,m的摩尔质量为p的2倍,n是元素Y的单质,q能使品红溶液褪色.上述的转化关系如图所示.下列说法中不正确的是( )
短周期元素W、X、Y、Z的原子序数依次增大.m、p、q、r、s是由这些元素组成的二元化合物,常温常压下r 为液体,其余均为无色气体,m的摩尔质量为p的2倍,n是元素Y的单质,q能使品红溶液褪色.上述的转化关系如图所示.下列说法中不正确的是( )| A. | 原子半径:Y<X<Z | B. | 非金属性:Y>X>W | ||
| C. | m与q、n与s均不能共存 | D. | 若n过量,q还可以继续燃烧 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com