
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:解答题
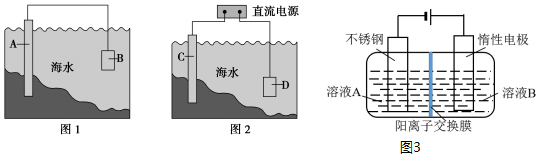
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 在熔融状态下,1molNa2O2 完全电离出的离子数目为 3NA | |
| B. | 将 CO2 通过 Na2O2 使固体质量增加 mg,反应中转移的电子数 m NA/14 | |
| C. | 在标准状况下,22.4LCH4与 18 gH2O 所含有的电子数均为 10NA | |
| D. | 含 1mol Cl-的 NH4Cl 溶液中加入适量氨水使溶液呈中性,此时溶液中NH4+的数目为NA. |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1:2 | B. | 8:1 | C. | 1:1 | D. | 800:108 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 15mol 20% | B. | 20mol 20% | C. | 20mol 80% | D. | 40mol 80% |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 镀铜铁制品镀层破损后,铁制品比破损前更容易生锈 | |
| B. | 标准状况下,22.4 L Cl2与足量NaOH溶液反应,转移电子数为2mol | |
| C. | 水的离子积常数Kw随着温度的升高而增大,说明水的电离是放热反应 | |
| D. | Na2CO3溶液中加入少量Ca(OH)2固体,CO32-水解程度减小,溶液的pH减小 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 次氯酸有酸性,可用于漂白、杀菌消毒 | |
| B. | 纯碱能与酸反应,可用作治疗胃酸过多的药物 | |
| C. | 液氨汽化时要吸收大量的热,工业上可用作制冷剂 | |
| D. | 晶体硅的熔点高、硬度大,可用于制作半导体材料 |
查看答案和解析>>
科目: 来源: 题型:实验题
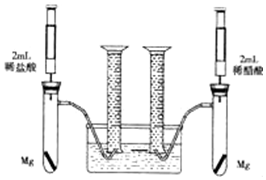 某化学小组为比较盐酸和醋酸的酸性强弱,设计了如下实验方案.装置如图(夹持仪器略)
某化学小组为比较盐酸和醋酸的酸性强弱,设计了如下实验方案.装置如图(夹持仪器略)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com