
科目: 来源: 题型:选择题
 PH=1的两种溶液A、B各1mL,分别加水稀释到1000mL,分别加水稀释到1000mL,其pH与溶液体积(V)的关系如图示,下列说法正确的是( )
PH=1的两种溶液A、B各1mL,分别加水稀释到1000mL,分别加水稀释到1000mL,其pH与溶液体积(V)的关系如图示,下列说法正确的是( )| A. | ①④ | B. | ②③ | C. | ①② | D. | ②④ |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:实验题
 工业上,向500℃左右的铁屑中通入Cl2生产无水氯化铁,其制备过程中均要确保无水.现模拟该过程用图示装置进行实验:
工业上,向500℃左右的铁屑中通入Cl2生产无水氯化铁,其制备过程中均要确保无水.现模拟该过程用图示装置进行实验:查看答案和解析>>
科目: 来源: 题型:实验题
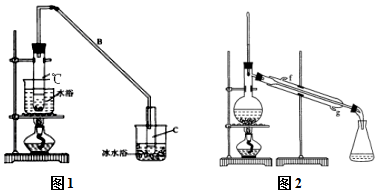 某化学小组采用类似制乙酸乙酯的装置(如图1),以环己醇制备环己烯
某化学小组采用类似制乙酸乙酯的装置(如图1),以环己醇制备环己烯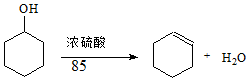
| 密度(g/cm3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
| 环己醇 | 0.96 | 25 | 161 | 能溶于水 |
| 环己烯 | 0.81 | -103 | 83 | 难溶于水 |
查看答案和解析>>
科目: 来源: 题型:选择题
 A、B、C是元素周期表中前18号元素中的3种元素,甲是常见化合物,常温下呈液态,A原子在同周期中半径最小,它们之间存在如图所示关系,下列说法错误的是( )
A、B、C是元素周期表中前18号元素中的3种元素,甲是常见化合物,常温下呈液态,A原子在同周期中半径最小,它们之间存在如图所示关系,下列说法错误的是( )| A. | 原子半径大小:B>A>C | |
| B. | 气态时稳定性:乙>甲 | |
| C. | 与甲含相同元素的另一化合物既有极性键也有非极性键 | |
| D. | 等浓度时,乙的水溶液在A的同主族无氧酸中酸性最强 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 用洁净的铂丝蘸取某溶液在酒精灯火焰上灼烧,若通过蓝色的钴玻璃观察火焰呈紫色,则原溶液中一定有K+离子,一定没有Na+离子 | |
| B. | 向某溶液中加入AgNO3溶液有白色沉淀产生,再加稀HNO3,沉淀不消失,则原溶液中一定有Cl- | |
| C. | 向某溶液中加入BaCl2溶液有白色沉淀,再加稀HNO3,沉淀不消失,则原溶液中一定有SO42- | |
| D. | 向某溶液中加入稀盐酸若产生能使用澄清石灰水变浑浊的气体,则原溶液中一定有CO32- |
查看答案和解析>>
科目: 来源: 题型:选择题

| A. | 浓硫酸能加快酯化反应速率 | B. | 不断蒸出酯,会降低其产率 | ||
| C. | 装置b比装置a原料损失的少 | D. | 可用分液的方法分离出乙酸乙酯 |
查看答案和解析>>
科目: 来源: 题型:选择题
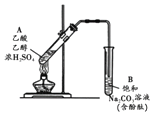 某同学利用如图所示装置制备乙酸乙酯.实验如下:
某同学利用如图所示装置制备乙酸乙酯.实验如下:| A. | ①中加热利于加快酯化反应速率,故温度越高越好 | |
| B. | ③中油状液体层变薄主要是乙酸乙酯溶于Na2CO3溶液所致 | |
| C. | ③中红色褪去的原因可能是酚酞溶于乙酸乙酯中 | |
| D. | 取②中上层油状液体测其核磁共振氢谱,共有3组峰 |
查看答案和解析>>
科目: 来源: 题型:实验题
 Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定.
Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定.查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com