
科目: 来源: 题型:解答题
| 弱酸 | HCOOH | HClO | H2CO3 | H2SO3 |
| 电离平衡常数(25℃) | Ka=1.77×10-4 | Ka=4.0 ×10-8 | Ka1=4.3×10-7 Ka2=4.7×10-11 | Ka1=1.54×10-2 Ka2=1.02×10-7 |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 向Ba(OH)2溶液中逐滴加入NH4HSO4溶液至刚好沉淀完全:Ba2++2OH-+H++SO42-+NH4+=BaSO4↓+NH3•H2O+H2O | |
| B. | 将少量SO2气体通入NaClO溶液中:SO2+H2O+ClO-=SO42-+Cl-+2H+ | |
| C. | Na2CO3溶液中滴加几滴稀盐酸:CO32+H+=HCO3- | |
| D. | NaHCO3溶液中滴加少量澄清石灰水:2HCO3-+Ca2++2OH-=CaCO3↓+2H2O+CO32- |
查看答案和解析>>
科目: 来源: 题型:选择题
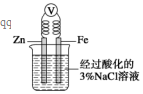
| A. | 将一小块铜片放入盛有浓硫酸的试管中加热反应后的溶液呈蓝色 | |
| B. | 将一小块钠放入盛有水的烧杯中,钠在水面上游动,同时看到烧杯内的溶液变为红色 | |
| C. | 如图,一段时间后给烧杯内的溶液中加入氢氧化钠溶液,可看到Fe电极附近有红褐色沉淀生成 | |
| D. | 向盛有少量Mg(OH)2沉淀悬浊液的试管中滴加氯化铵溶液,可看到沉淀溶解 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 混合溶液pH>7 | |
| B. | 对混合溶液进行微热,K1增大、K2减小 | |
| C. | 调节混合溶液的pH至中性,则此时溶液中c(Na+)=c(CH3COO-) | |
| D. | 温度不变,若在混合溶液中加入少量NaOH固体,c(CH3COO-)减小 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | pH=1的NaHSO4溶液:c(H+)=c(SO42-)+c(OH-) | |
| B. | pH=5的下列溶液(①NH4Cl溶液②CH3COOH溶液;③稀盐酸)中由水电离出来的c(H+)水 ①>②>③ | |
| C. | pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH)<c(Na2CO3)<c(CH3COONa) | |
| D. | pH相同的下列三种溶液(①CH3COONa、②NaHCO3、③NaClO)中的c(Na+):①>②>③ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ②④ | B. | ①③⑥ | C. | ①②⑤ | D. | ①②④ |
查看答案和解析>>
科目: 来源: 题型:选择题
 已知反应:2SO2(g)+O2(g)?2SO3(g)△H<0.某温度下,将2mol SO2和1mol O2置于10L密闭容器中,反应达平衡后,SO2的平衡转化率(α)与体系总压强(p)的关系如图甲所示.则下列说法正确的是( )
已知反应:2SO2(g)+O2(g)?2SO3(g)△H<0.某温度下,将2mol SO2和1mol O2置于10L密闭容器中,反应达平衡后,SO2的平衡转化率(α)与体系总压强(p)的关系如图甲所示.则下列说法正确的是( )| A. | 由图甲知,A点SO2的平衡浓度为0.4 mol/L | |
| B. | 由图甲知,B点SO2、O2、SO3的平衡浓度之比为2:1:2 | |
| C. | 达平衡后,缩小容器容积,v正和v逆都增大 | |
| D. | 增大SO2浓度,v正增大v逆减小 |
查看答案和解析>>
科目: 来源: 题型:选择题
| 反应时间/min | 0 | 10 | 20 | 30 | 40 | 50 |
| c(N2O)/mol•L-1 | 0.100 | 0.090 | 0.080 | 0.070 | 0.060 | 0.050 |
| 反应时间/min | 60 | 70 | 80 | 90 | 100 | |
| c(N2O)/mol•L-1 | 0.040 | 0.030 | 0.020 | 0.010 | 0.000 |
| A. | 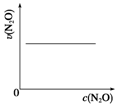 | B. |  | C. | 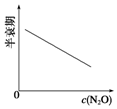 | D. |  |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com