
科目: 来源: 题型:选择题
| A. | 溶液中导电粒子的数目减少 | |
| B. | 溶液中$\frac{c(C{H}_{3}COO)}{c(C{H}_{3}COOH)•c(OH)}$不变 | |
| C. | 醋酸的电离程度增大,c(H+ )也增大 | |
| D. | 再加入 10mL0.1mol/L 的 NaOH 溶液,混合液的 pH=7 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Na能与CuSO4溶液反应置换出红色的铜 | |
| B. | Na2O是碱性氧化物,与酸反应生成盐和水 | |
| C. | Na2O和Na2O2都能与水反应,生成物完全相同 | |
| D. | Na2O2是白色固体,可用于呼吸面具中氧气的来源 |
查看答案和解析>>
科目: 来源: 题型:填空题
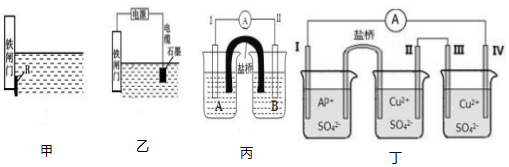
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 等质量的硫蒸气和硫磺分别完全燃烧,二者放出的热量一样多 | |
| B. | 氢气的燃烧热为 285.8kJ/mol,则氢气燃烧的热化学方程式为 2H2(g)+O2(g)=2H2O(l)△H=-285.8kJ/mol | |
| C. | 2H2(g)+O2(g)=2H2O(l)△H=-Q1kJ/mol 2H2(g)+O2(g)=2H2O(g)△H=-Q2kJ/mol,则 Q1>Q2 | |
| D. | 已知中和热为 57.3 kJ/mol,若将含 0.5molH2SO4的浓溶液与含 1molNaOH 的溶液混合,放出的热量等于 57.3kJ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | C2H4和C3H6的混合物的质量为a g,所含碳氢键数目为aNA/7 | |
| B. | 1.0 L 1.0 mol•L-1的NaAlO2水溶液中含有的氧原子数为2NA | |
| C. | 25℃时pH=13的NaOH溶液中含有OH-的数目为0.1NA | |
| D. | 1 mol的羟基与1 mol的氢氧根离子所含电子数均为9NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①② | B. | ②④ | C. | ③④ | D. | ①③ |
查看答案和解析>>
科目: 来源: 题型:解答题
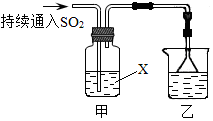
查看答案和解析>>
科目: 来源: 题型:填空题
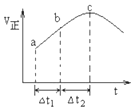 NO2与SO2混合可发生反应:NO2+SO2?SO3+NO.在100℃1molNO2与1molSO2的混合气体置于绝热(不与外界进行热交换)恒容密闭容器中发生上述反应,①正反应速率随时间变化的趋势如图所示,则下列说法正确的是C(填字母).
NO2与SO2混合可发生反应:NO2+SO2?SO3+NO.在100℃1molNO2与1molSO2的混合气体置于绝热(不与外界进行热交换)恒容密闭容器中发生上述反应,①正反应速率随时间变化的趋势如图所示,则下列说法正确的是C(填字母).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com