
科目: 来源: 题型:多选题
| A. | 原NH4HCO3溶液中:c(HCO3-)>c(NH4+)>c(OH-)>c(H+) | |
| B. | 原NH4HCO3溶液中:c(OH-)=c(H+)-c(CO32-)-c(NH3•H2O)+c(H2CO3) | |
| C. | 析出晶体后的溶液中:c(Cl-)=c(NH4+),c(Na+)=c(HCO3-) | |
| D. | 析出晶体后的溶液中:c(H+)+c(H2CO3)=c(OH-)+c(CO32-)+c(NH3•H2O) |
查看答案和解析>>
科目: 来源: 题型:解答题
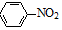 +4Mg+8CH3OH→
+4Mg+8CH3OH→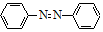 +4Mg(OCH3)2+4H2O
+4Mg(OCH3)2+4H2O
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:多选题
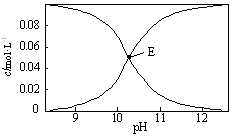 20℃时,配制一组c(Na2CO3)+c(NaHCO3)=0.100mol•L-1的混合溶液,溶液中c(HCO3-)、c(CO32-)与pH的关系如图所示.下列指定溶液中微粒的物质的量浓度关系正确的是( )
20℃时,配制一组c(Na2CO3)+c(NaHCO3)=0.100mol•L-1的混合溶液,溶液中c(HCO3-)、c(CO32-)与pH的关系如图所示.下列指定溶液中微粒的物质的量浓度关系正确的是( )| A. | pH=9的溶液中:c(HCO3-)>c(H2CO3)>c(CO32-) | |
| B. | c(HCO3-)=c(CO32-)的E点溶液中:c(OH-)+c(CO32-)>c(H+)+c(H2CO3)+0.050 mol•L-1 | |
| C. | pH=11的溶液中:c(Na+)<2c(CO32-)+c(HCO3-) | |
| D. | 0.100 mol•L-1的Na2CO3溶液中:c(H+)+c(H2CO3)+c(HCO3-)=c(OH-) |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 6种 | B. | 7种 | C. | 8种 | D. | 9种 |
查看答案和解析>>
科目: 来源: 题型:推断题
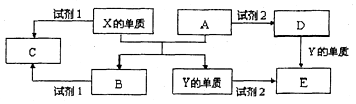 A、B、C、D、E是中学常见的5种化合物,A、B是氧化物,元素X、Y的单质是生活中常见的金属,相关物质间的关系如图所示.
A、B、C、D、E是中学常见的5种化合物,A、B是氧化物,元素X、Y的单质是生活中常见的金属,相关物质间的关系如图所示.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 均增大 | B. | 均不变 | C. | ①增大,②不变 | D. | ①减小,②不变 |
查看答案和解析>>
科目: 来源: 题型:推断题
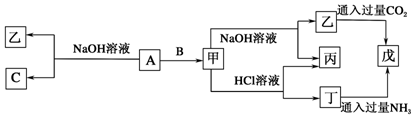
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 铝镁合金的硬度较大,钠钾合金的硬度较小 | |
| B. | 因为钠的金属性比镁要强,所以钠的熔点比镁要高 | |
| C. | 镁能置换硫酸铜溶液中的铜,钠也能置换硫酸铜溶液中的铜 | |
| D. | 在空气中都能被点燃,生成的产物都是氧化物,氧在产物中的化合价都是-2 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 半导体行业中有一句话:“从沙滩到用户”,计算机芯片的材料是二氧化硅 | |
| B. | 硫酸铁易溶于水,可作净水剂 | |
| C. | 我国首艘航母“辽宁舰”上用于舰载机降落的拦阻索是特种钢缆,属于金属材料 | |
| D. | 减少烟花爆竹的燃放,有利于降低空气中的PM2.5含量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com