
科目: 来源: 题型:解答题
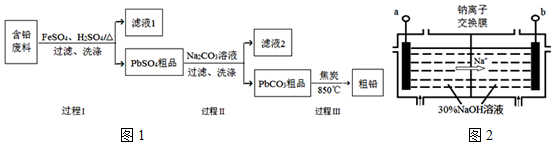
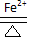 2PbSO4+2H2O.
2PbSO4+2H2O.查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:实验题
 工业上常用电解氯化亚铁的方法获得氧化剂,吸收有毒的气体.某小组同学欲探究1 mol/L FeCl2溶液的电解产物.
工业上常用电解氯化亚铁的方法获得氧化剂,吸收有毒的气体.某小组同学欲探究1 mol/L FeCl2溶液的电解产物.| 序号 | 实验装置 | 阳极实验现象 | 阴极 |
| 实验Ⅰ | 电压1.5V电解1 mol/L FeCl2溶液,pH=4.9 | 阳极表面没有气泡生成;阳极附近溶液逐渐变浑浊,颜色变成黄绿色;最终石墨电极表面附有少量红褐色固体. | 没有观察到气泡生成,铜电极表面有银灰色金属光泽的固体析出. |
| 实验序号 | pH | 阳极 | 阴极 | |||
| 是否有气泡产生 | 湿润淀粉碘化钾试纸是否变蓝 | 电极附近溶液颜色变化 | 是否有气泡产生 | 电极表面是否出现镀层 | ||
| 实验Ⅱ | 2.4 | 无 | 未变色 | 黄绿色,少量浑浊 | 无 | 有 |
| 实验Ⅲ | -0.4 | 无 | 未变色 | 黄绿色,无浑浊 | 有 | 无 |
| 实验序号 | 电压 (V) | 阳极 | 阴极 | |||
| 是否有气泡产生 | 湿润淀粉碘化钾试纸是否变蓝 | 电极附近溶液颜色变化 | 是否有气泡产生 | 电极表面是否出现镀层 | ||
| 实验Ⅳ | 3 | 无 | 未变色 | 缓慢变成黄绿色,有浑浊 | 少量 | 有,约1min |
| 实验Ⅴ | 6 | 少量 | 变蓝 | 很快变成黄绿色,有浑浊 | 大量 | 有,迅速 |
查看答案和解析>>
科目: 来源: 题型:解答题
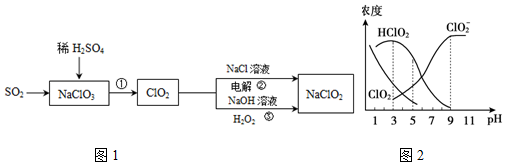
查看答案和解析>>
科目: 来源: 题型:选择题
 常温下,用1L1mol•L-1Na2SO3溶液吸收SO2时,溶液pH随SO2的物质的量的变化如图所示,下列说法正确的是( )
常温下,用1L1mol•L-1Na2SO3溶液吸收SO2时,溶液pH随SO2的物质的量的变化如图所示,下列说法正确的是( )| A. | Na2SO3溶液中:c(Na+)>c(SO32-)>c(HSO3-)>c(OH-)>c(H+) | |
| B. | 当吸收液呈中性时,c(Na+)=c(HSO3-)+2c(SO32-) | |
| C. | M 点时溶液中:c(SO32-)>c(HSO3-) | |
| D. | 向N点的吸收液中加水可使溶液的pH由6.2升高到7.4 |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:解答题
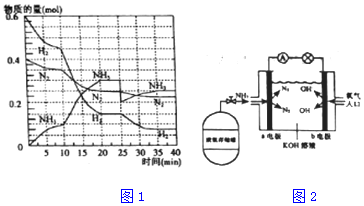
查看答案和解析>>
科目: 来源: 题型:选择题
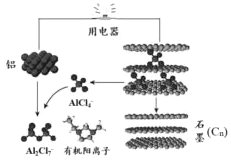 2015年斯坦福大学研究人员研制出一种可在一分钟内完成充放电的超常性能铝离子电池,内部用AlCl4-和有机阳离子构成电解质溶液,其放电工作原理如图所示.下列说法不正确的是( )
2015年斯坦福大学研究人员研制出一种可在一分钟内完成充放电的超常性能铝离子电池,内部用AlCl4-和有机阳离子构成电解质溶液,其放电工作原理如图所示.下列说法不正确的是( )| A. | 充电时的阳极反应为:Cn+AlCl4--e-=CnAlCl4 | |
| B. | 放电时,铝为负极、石墨为正极 | |
| C. | 放电时,有机阳离子向铝电极方向移动 | |
| D. | 放电时的负极反应为:Al-3e-+7AlCl4-=4Al2Cl7- |
查看答案和解析>>
科目: 来源: 题型:解答题
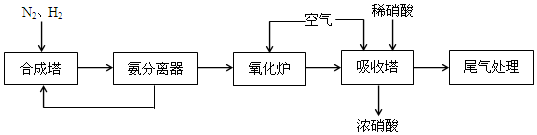
 2NH3,该反应中的氧化剂是N2.
2NH3,该反应中的氧化剂是N2.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com