
科目: 来源: 题型:选择题
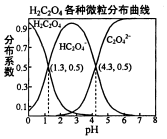 常温下,0.1mol/L的H2C2O4溶液中H2C2O4、HC2O4-、C2O42-三者中所占物质的量分数〔分布系数)随PH变化的关系如图所示.下列表述不正确的是( )
常温下,0.1mol/L的H2C2O4溶液中H2C2O4、HC2O4-、C2O42-三者中所占物质的量分数〔分布系数)随PH变化的关系如图所示.下列表述不正确的是( )| A. | HC2O4-?H++C2O42-,K=1×10-4.3 | |
| B. | 将等物质的量的NaHC2O4、Na2C2O4溶于水中,所得溶液PH恰好为4.3 | |
| C. | 常温下HF的KB=1×10--3.45,将少量H2C2O4溶液加入到足量NaF溶液中,发生的反应为:H2C2O4+F-=HF+HC2O4- | |
| D. | 在0.1mol/LNaHC2O4溶液中,各离子浓度大小关系为:c(Na+)>c(HC2O4-)>c(C2O42-)>c(OH-) |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 用SO2漂白过的草帽日久会变色 | |
| B. | 用天燃气代替煤作燃料可减少大气污 | |
| C. | “84消毒液”杀死病菌是因为蛋白质变性 | |
| D. | 乙醇用作医用消毒剂时,无水乙醇消毒效果最好 |
查看答案和解析>>
科目: 来源: 题型:解答题
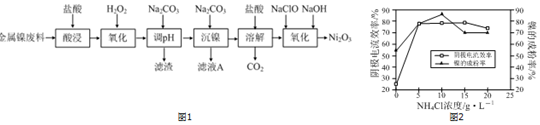
查看答案和解析>>
科目: 来源: 题型:解答题
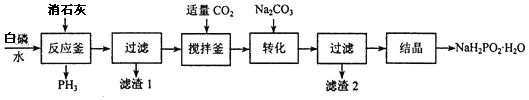
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 2 mol FeSO4发生反应时,反应中共有10 mol电子转移 | |
| B. | 每生成16g氧气就有1molFe2+被还原 | |
| C. | Na2O2只作氧化剂 | |
| D. | 氧化产物只有Na2FeO4 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | NF3分子的空间构型为三角锥形 | |
| B. | 叠氮酸(HN3)是一种弱酸,可部分电离出H+和N3-,则N2O与N3-互为等电子体 | |
| C. | 叠氮化物与Co3+等形成配合物,如:[Co(N3)(NH3)5]SO4,则其中钴的配位数为8 | |
| D. | NaN3与KN3的结构类似,则NaN3的晶格能大于KN3的晶格能 |
查看答案和解析>>
科目: 来源: 题型:解答题
| C6H5Cl(氯苯) | C6H4Cl2 | FeCl3 | FeCl2 | |
| 溶解性 | 不溶于水,易溶于苯 | 不溶于C6H5Cl、C6H4Cl2、苯,易吸水. | ||
| 熔点/℃ | -45 | 53 | -- | -- |
| 沸点/℃ | 132 | 173 | -- | -- |
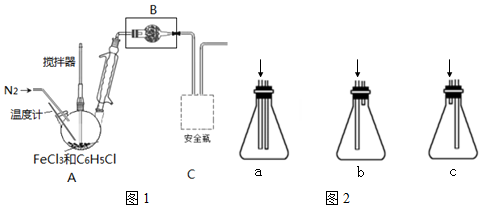
查看答案和解析>>
科目: 来源: 题型:解答题
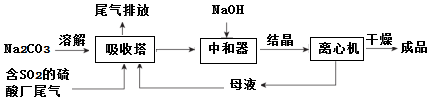
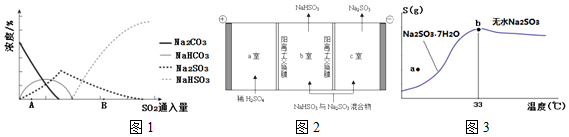
查看答案和解析>>
科目: 来源: 题型:解答题
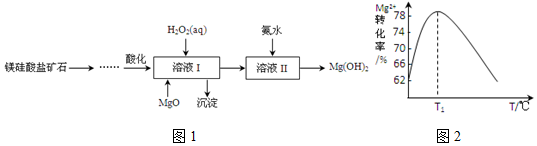
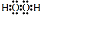 .溶液 I中加入H2O2溶液发生反应的离子方程式是2Fe2++H2O2+2H+=2Fe3++2H2O.
.溶液 I中加入H2O2溶液发生反应的离子方程式是2Fe2++H2O2+2H+=2Fe3++2H2O.查看答案和解析>>
科目: 来源: 题型:实验题
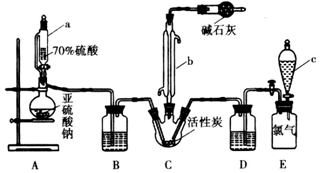
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com